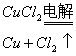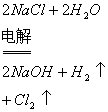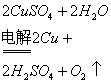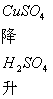如何自主学习《电解原理及其应用》
时间:2007-06-14 01:30 来源: 作者:单莹 点击:次 所属专题: 电解池
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
电解池原理及其应用是电解质溶液理念中非常重要的部分,最好与已经学过的原电池原理及其应用进行类比学习。根据新课程的理念,要学会自主学习,从而培养自主学习的能力。为此建议同学们学会自主概括电化学的主干知识,自主列表比较有关电化学的概念和理论,自主归纳有关电化学的规律。具体采用如下方法进行学习。
1. 自主列表比较电化学有关知识
原电池、电解池原理、电极反应、电流或电子的流向、电极反应产物判断等是高考常考点,同学们完全可以通过自己努力先阅读课本,然后将电化学的这些主干知识联系起来,自主列表比较。通过开通贮存在自己大脑的信息渠道,自主梳理,展开联想,归纳类比,以此达到真正掌握有关电化学知识的目的。下表是对“电解池”中知识要点的总结:
|
|
知识要点 |
实例 |
|
电解原理 |
通过直流电使电解质离子在电极上发生氧化还原反应,使电能转化为化学能。 |
|
|
电解池 |
将电能转化为化学能的装置,由直流电源、电极、导线和电解质溶液构成。 |
|
|
电极构成 |
分阴阳两极(电极由原电池正负极来主宰):阴极与电池负极相连,阳极与电池的正极相连。 |
|
|
电极反应 |
阴极(还原电极):得电子发生还原反应; 阳极(氧化电极):失电子发生氧化反应, |
|
|
电流方向 |
由直流电源的连接方式决定 |
|
|
总反应式 |
阴、阳极在外电源作用下所发生的受迫氧化还原反应 |
|
|
电极产物 判断规律 |
阴极材料不参加反应,还原反应顺序:是物质的氧化性由强到弱的顺序: 阳极:惰性材料(
|
|
2. 自主总结有关电化学的规律
同学们要真正掌握电化学的有关知识,首先要深刻理解氧化还原反应与电化学知识间的内在联系,在掌握原电池原理,电解原理的基础上,然后学会自主总结有关电化学的有关规律,正确书写各种电极反应方程式或进行有关计算。如以惰性材料作电极,电解酸、碱、盐等电解质溶液得到电解的规律。把电解质离子与水电离出来的![]() 纳入框架内,根据氧化性离子在阴极放电顺序,还原性离子在阳极放电顺序,作出正确判断,从而得到电解的规律和电解后溶液的
纳入框架内,根据氧化性离子在阴极放电顺序,还原性离子在阳极放电顺序,作出正确判断,从而得到电解的规律和电解后溶液的![]() 变化。具体见下表。
变化。具体见下表。
![]() (
(![]() )
)![]()
在水溶液中不放电记为A 在水溶液放电记为B
![]()
![]()
![]()
在水溶液中放电记为C 在水溶液中不放电记为D
如果不记电价,从解角度出发,可以组合成的电解质的种类有:AB、AD、AOH、BC、BOH、BD、HC、HD。以惰性电极电解这些电解质溶液,分三种情况讨论:
(1)电解质不被电解,只增强导电性:强碱、HD、HF、AD、AF
(2)只电解电解质:低价含氧酸根、无氧酸(HF除外)、BOH、BC
(3)水与电解质都被电解:AC、BD、BF。
|
项目 物质 |
代表 物质 |
电解 物质 |
阴极 |
阳极 |
电解方程式 |
浓度 变化 |
阳极 |
阴极 |
溶液 |
|
|
酸 |
HD |
|
|
|
|
|
增大 |
降低 |
升高 |
降低 |
|
HC |
|
|
|
|
|
降低 |
不变 |
升高 |
升高 |
|
|
碱 |
强碱 |
|
|
|
|
|
升高 |
不变 |
升高 |
升高 |
|
盐 |
BC |
|
|
Cu |
|
|
降低 |
稍变 |
稍变 |
基本不变 |
|
AC |
|
|
|
|
|
|
基本不变 |
升高 |
升高 |
|
|
BD |
|
|
|
|
|
|
降低 |
基本不变 |
降低 |
|
|
AD |
|
|
|
|
|
升高 |
降低 |
升高 |
不变 |
|
判断溶液电极反应先后顺序:抓住溶液中离子得失电子的能力,最易失电子的阴离子最先在阳极失电子被氧化;最易得电子的阳离子在阴极最先得电子被还原。判断溶液的pH变化:先分析原溶液的酸碱性,再看电极产物:①如果只生产![]() 而没有
而没有![]() ,则
,则![]() 变大;②如果只产生
变大;②如果只产生![]() 而无
而无![]() ,
,![]() 变小;③如果既产生
变小;③如果既产生![]() ,又产生
,又产生![]() ,若原溶液呈酸性,溶液
,若原溶液呈酸性,溶液![]() 减小;若原溶液是碱性,溶液
减小;若原溶液是碱性,溶液![]() 增大;若原溶液呈中性
增大;若原溶液呈中性![]() 不变。
不变。
3. 运用学以致用的观点对电解原理应用的学习
(1)电镀:利用电解原理,用待镀金属作阴极,镀层金属作阳极,用镀层金属盐作电解质溶液,通直流电,使阳极溶解,镀层金属离子在阴极还原,均匀分布在镀件材料表面。它既可以在金属材料上电镀金属,也可以在塑料表面进行电镀。
(2)电解精炼铜:粗铜作阳极,精铜作阴极,硫酸铜溶液作电镀液,通电后:阴极(精铜)![]()
阳极(粗铜):![]()
粗铜中的杂质:较活泼的金属失电子形成阳离子进入电镀液中,比铜活性差的金属沉积在阳极底部形成阳极泥,得到贵重金属金、银等。
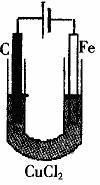
(3)电解饱和食盐水:
通电前:![]()
![]()
![]()
![]()
通电时![]() 、
、![]() 趋向阴极,氧化性
趋向阴极,氧化性![]() ,所以
,所以![]() ;
;![]() 、
、![]() 趋向阳极,
趋向阳极,![]() 浓度比
浓度比![]() 高,还原性比
高,还原性比![]() 强,所以:
强,所以:![]()
总反应式:![]()
(4)电解制铝:原料:纯![]() 被电解物质,冰晶石
被电解物质,冰晶石![]() (降低熔点)
(降低熔点)
电解槽:阳极:碳块,阴极:碳块和钢导电棒。
原理:在熔化条件下:![]()
反应:阴极:![]()
阳极:![]() (可能腐蚀碳棒)
(可能腐蚀碳棒)
总反应式:![]() 。冰晶石作为助熔剂,电解过程中要不断补充碳块。
。冰晶石作为助熔剂,电解过程中要不断补充碳块。
4. 通过典型题例部析,培养各种能力
题例剖析的目的是通过学会审题,形成解题思路,总结解题规律和技巧,达到解答的规范性。同学们可以籍此自主归纳解题规律,培养各种能力。
例 在玻璃圆筒中盛有两种无色的互不相溶的中性液体。上层液体中插入两根石墨电极,圆筒内还放有一根下端弯成环状的玻璃搅捧,可以上下搅动液体,装置如图。接通电源,阳极周围的液体呈现棕色,且颜色由浅变深,阴极上有气泡生成。停止通电,取出电极,用搅棒上下剧烈搅动。静置后液体又分成两层,下层液体呈紫红色,上层液体几乎无色。根据上述实验回答:
(1)阳极上的电极反应式为________________。
(2)阴极上的电极反应式为________________。
(3)原上层液体是________________________。
(4)原下层液体是________________________。
(5)搅拌后两层液体颜色发生变化的原因是___________________________。
(6)要检验上层液体中含有的金属离子,其方法是_________________,现象是_______________。
解析:本题是以电解知识为主干,考查了电极反应方程式的书写以及电解原理的应用。但在此实验试题中实际上隐含了对实验基本知识(如萃取原理、焰色反应)的考查,同时在试题中推测溶液的成分富有一定的开放性,而本实验试题的解题的突破口是对实验现象的分析。本题通过溶液分层现象及上层溶液能进行电解可以推断上下两层溶液为无机试剂和有机试剂,通过阳极周围溶液颜色的变化及静置后下层液体显紫色可以推测电解溶液为碘盐溶液,再根据溶液为中性,可进一步推测电解液应为中学中常见的钠盐或钾盐溶液。再根据电极反应方程式的书写规律和基本实验的分析可以顺利完成试题中的问题。
答案:(1)![]()
(2)![]()
(3)![]()
(4)![]()
(5)![]() 在
在![]() 中的溶解度大于在水中的溶解度,所以绝大部分
中的溶解度大于在水中的溶解度,所以绝大部分![]() 都转移到
都转移到![]() 中。
中。
(6)焰色反应,透过蓝色钴玻璃观察火焰呈紫色(若③中答![]() 水溶液,这里答火焰呈黄色)。
水溶液,这里答火焰呈黄色)。
5. 通过有关电化学实验的探究、培养实践能力和创新精神
事实上运用电化学实验进行探究,也是一种很好的学习方法。同学们尽可能地补做一些重要的电化学实验,唤起回忆,加深印象,纠正错误,熟练技能,重新审视,有所发现,从而真正达到培养实践能力和创新精神的目的。

- 全部评论(0)