压强差在化学实验中的应用
时间:2020-03-07 13:16 来源: 作者:郝军 点击:次 所属专题: 实验与压强
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、装置气密性的检验
原理:通过某种操作可使装置内部气体压强与外界大气压强不相等,形成一定的压强差,产生一定的现象加以判断。
方法:
1、微热法:
⑴原理:利用气体受热膨胀的原理增大压强,使装置内部气体压强大于外界大气压强,形成一定的压强差,产生一定的现象加以判断。
⑵微热的操作方式有:①用酒精灯给仪器微热,②用手掌心握住仪器微热。
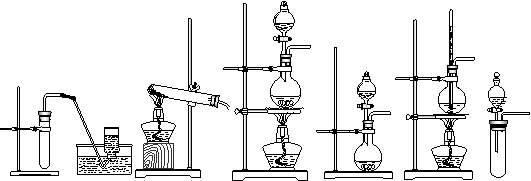
⑶适用的范围:气体发生装置有一个(或通过止气夹,活塞等仪器使该装置变成只有一个)与大气相同的导气孔。
⑷具体的做法及现象:将导气管放入水中,给气体发生装置微热,若不漏气将观察到:导气管末端有气泡产生,停止微热后导气管末端有一段倒吸的水柱。此时的压强情况是气体发生装置内部气体压强大于外界大气压强。
⑸典型实验:①固固加热制气:实验室制氧气、氨气等,②固液加热制气:实验室制氯气、氯化氢等,③固液不加热制气:实验室制氢气、二氧化碳等,液液加热制气:实验室制乙烯等。
⑹装置特征:常见装置如下:
⑴原理:利用某种操作使气体发生装置内部的气体压强与外界大气压强不相等,产生一定的现象加以判断。
⑵适用的范围:启普发生器(或简易启普发生器及原理相近的气体发生装置)等。
⑶具体的做法及现象:首先将导气管上的止气夹或活塞打开,通过长颈漏斗或球形漏斗向气体发生装置内加水至漏斗颈末端浸没在水中,然后将止气夹或活塞关闭,再次从漏斗中注入一定量的水,使漏斗内的水面高于试管内的水面,停止加水后,漏斗中与试管中液面差保持不在变化,说明装置气密性良好。
此时的压强情况是;外界大气压强与漏斗内液柱的压强和等于气体发生装置内气柱压强与液柱压强之和。
⑷典型实验:①固液不加热制气:实验室利用启普发生器制氢气、二氧化碳等,②简易启普发生器及原理相近的气体发生装置进行相关实验。
⑸装置特征:常见装置如下:
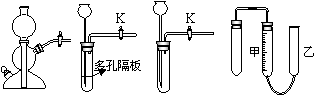
![]()
以上操作虽然方法不同,但原理相近,因此万变不离其根本。
应用:
例1、(2001高考江苏理综卷28题)用图示的装置制取氢气,在塑料隔板上放锌粒,漏斗和带支管的试管中装有稀硫酸,若打开弹簧夹,则硫酸由漏斗流下,试管中液面上升与锌粒接触,发生反应,产生的氢气由支管导出;若关闭弹簧夹,则试管中液面下降,漏斗中液面上升,酸液与锌粒脱离接触,反应自行停止,需要时再打开弹簧夹,又可以使氢气发生。这是一种仅适用于室温下随制随停的气体发生装置。回答下面问题:
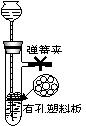
⑴为什么关闭弹簧夹时试管中液面会下降?⑵这种制气装置在加入反应物前,怎样检查装置的气密性?
答案:⑴关闭弹簧夹时,反应产生的气体使试管内液面上的压力增加,所以液面下降。
⑵塞紧橡皮塞,夹紧弹簧夹后,从漏斗中注入一定量的水,使漏斗内的水面高于试管内的水面,停止加水后,漏斗中与试管中液面差保持不在变化,说明装置气密性良好。
例2、(2004高考内蒙理综卷28题)根据下图及描述,回答下列问题:
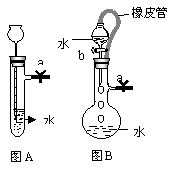
⑴关闭图A装置中的止水夹a后,从长颈漏斗向试管中注入一定量的水,静止后如图所示。试判断:A装置是否漏气?(填漏气”、“不漏气”或“无法确定”) ,判断理由是
⑵关闭图B装置中的止水夹a后,开启活塞b,水不断往下滴,直至全部流入烧瓶。试判断:B装置是否漏气?填“漏气”、“不漏气”或“无法确定”) ,判断理由是 。
答案:⑴ 不漏气,由于不漏气,加水后试管内气体体积减小,导致压强增大,长颈漏斗内的水面高出试管内的水面。
⑵ 无法确定,由于分液漏斗和烧瓶之间有橡皮管相连,使分液漏斗液面上方和烧瓶中液面上方的压强相同,无论装置是否漏气,都不影响分液漏斗中的液体滴入烧瓶
二、喷泉实验
原理:利用烧瓶内的气体易溶于水(或其他液体)而使其内部气压急剧减小,当压强小于外面的大气压,产生压强差,在压强差的作用下,烧杯中的水(或其他溶液)被压入烧瓶内形成喷泉。
成功条件:喷泉实验能否成功,关键是烧瓶内外产生压强差的大小。
⑴内因:用于做实验的气体必须是易溶于水或所选的溶液。
⑵外因:a烧瓶要干燥;b气体要收满;c装置不漏气;d滴管中挤入的液体不能太少。
例:如图装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶。则a和b分别是

a(干燥气体) | b(液体) | |
A | NO2 | 水 |
B | CO2 | 4mol·LNaOH溶液 |
C | Cl2 | 饱和NaCl水溶液 |
D | NH3 | 1mol·L盐酸 |
分析:A中NO2虽溶于水,但最终溶液不能充满烧瓶。B中的CO2虽然较难溶于水,但是它能与NaOH发生反应,易被NaOH溶液吸收。能形成喷泉。C中的Cl2在饱和NaCl水溶液中的溶解度很小,不可能形成喷泉。D中的NH3极易溶于水,且与盐酸发生反应:NH3 +HCl = NH4Cl ,因此也能形成喷泉。
答案:BD
应用:
例1、(2000年上海综合高考题)喷泉是一种常见的自然现象,其产生的原因是存在压强差。
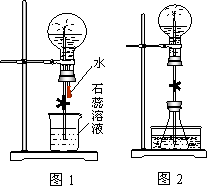
⑴ 图1为化学教学中所用的喷泉实验装置。在烧瓶中充满干燥气体,胶头滴管及烧杯中分别盛有液体。下列组合中不可能形成喷泉的是:
A HCl和H2O B O2和H2O C NH3和H2O D CO2和NaOH溶液
⑵ 某学生积极思考产生喷泉的其他办法,并设计了图2装置:
①在图2的锥形瓶中,分别加入足量的下列物质,反应后可能产生喷泉的是
A Cu 与稀盐酸 B NaHCO3 与NaOH溶液 C CaCO3与稀硫酸 DNH4HCO3稀盐酸
②在图2锥形瓶外放一水槽,锥形瓶中加入酒精,水槽中加入冷水后,再加入足量的下列物质,结果也产生了喷泉,水槽中加入的物质可以是
A 浓H2SO4 B 食盐 C 硝酸钾 D 硫酸铜
这种方法产生喷泉的原因是 。
⑶ 比较图1和图2两套装置,图1是 上部烧瓶内气体压强;图2 是 锥形瓶内气体的压强(均填“增大”或“减小”)
⑷ 火山爆发及城市中常见的人造喷泉的原理与上述 (填“图1”或“图2”)装置的原理相似。
答案:⑴ B
⑵ ① D ② A 浓硫酸溶于水放热,温度升高,酒精加快挥发,瓶内压强增大。
⑶ 减小 增大 ⑷ 图2
例2、(2002年全国高考理综29—Ⅱ)大气压强对许多物理实验和化学实验有着重要影响。制取氨气并完成实验(图中夹持装置均已略去)
⑴ 写出实验时制取氨气的化学方程式 。
⑵ 收集氨气应使用 法,要得到干燥的氨气 可选用 做干燥剂。
⑶用图1装置进行喷泉实验,上部烧瓶已装满干燥氨气,引发水上喷的操作是 。该实验的原理是 。
⑷如果只提供图2的装置,请说明引发喷泉的方法 。
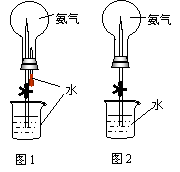
答案:⑴ 2NH4Cl + Ca(OH)2![]() 2NH3↑+ CaCl2 + 2H2O
2NH3↑+ CaCl2 + 2H2O
⑵ 向上排气取气法 碱石灰
⑶ 打开止水夹,挤出胶头滴管中的水,氨气极易溶于水,致使烧瓶内气体压强迅速减小
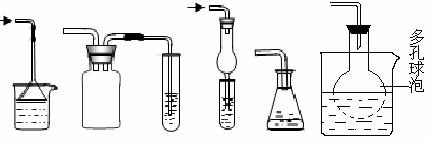
在化学实验中,压强差利用不当会产生负面影响,实验中气体的倒吸就是很典型的事例。因此在实验中必须克服压强差所造成的不良影响,变不利因素为有利因素。下列装置为常见防倒吸装置。
四、综合应用
例1、如图所示为“化学多米诺”实验,就好像多米诺骨牌一样,整个过程只需控制某一个反应,就会使若干个化学实验依次发生。各装置中试剂或物质是:
A 2mol/L H2SO4 B Zn C 2mol/L H2SO3+CuSO4 D Zn E CuSO4 溶液 F NH3·H2O G 30% H2O2 H H2S溶液 I NaOH溶液
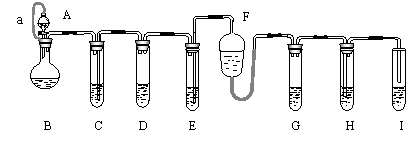
![]() 。该反应的产物可作为H2O2分解的催化剂。请回答下列问题。
。该反应的产物可作为H2O2分解的催化剂。请回答下列问题。
⑴如何检验装置的气密性? 。
⑵整个过程只需控制 反应,就会使若干实验依次发生。原理是 。
分析:
⑴关闭B装置中分液漏斗上的活塞,用水液封C、E、H中长导管的末端,并将I中导管插入水中,用酒精灯微热圆底烧瓶。观察到:C、E装置中液面下降,水进入导管并通过导管进入下一个装置内,F装置内液面下降H、I装置中有气泡产生。证明该装置不漏气。
⑵只需控制B装置中的反应。因为B装置中发生反应Zn+ H2SO4 = ZnSO4 + H2↑,H2进入C中导致压强增大,并将2mol/L H2SO3+CuSO4压入D中发生反应Zn+ H2SO3 = ZnsO3+H2↑,H2进入E中导致压强增大并将CuSO4溶液压入F中发生反应Cu2++ 4NH3·H2O = [Cu(NH3)4]2+ +4H2O![]() 。同时因压强增大液体进入G中引发2H2O2= 2H2O+O2↑,产生的氧气进入H中发生反应2H2S + O2 = 2H2O+2S。I为H2S的尾气吸收装置。
。同时因压强增大液体进入G中引发2H2O2= 2H2O+O2↑,产生的氧气进入H中发生反应2H2S + O2 = 2H2O+2S。I为H2S的尾气吸收装置。
例2、某学生为了使过滤操作能自动添加液体,设计了“自动加液过滤器”,如图所示。在倒置的烧瓶中盛放待过滤的液体,液体从“液体流出管”流入漏斗。为使液体顺利流下,还需插入“空气导入管”与大气相通。

⑴“空气导入管”下口应在 ,上口应在 。
A 滤纸边沿下方 B 滤纸边沿上方 C 待过滤液液面上 D 待过滤液中 E A和B项均可 F C和D项均可
⑵在图中画出“空气导入管”的简单示意图
⑶试简要说明自动过滤加液的原理 。
答案:⑴A ,C ⑵略 ⑶待过滤的液体沿液体流出管流入漏斗,当漏斗里的液面封住“空气导入管”的管口时,空气停止进入烧瓶,液体停止流入漏斗;随着过滤得进行,当漏斗里的液面降到空气导入管的下口以下时,空气又进入烧瓶,液体又流入烧瓶。这样循环往复,便完成了自动过滤加液的操作。
例3、(2001年全国高考20)某学生利用氯酸钾分解制氧气的反应,测定氧气的摩尔质量。实验步骤如下:
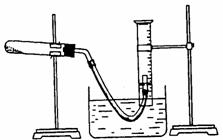
①把适量的氯酸钾粉末和少量二氧化锰粉末混合均匀,放入干燥的试管中,准确称量,质量为ag。
②装好实验装置。
③检查装置气密性。
④加热,开始反应,直到产生一定量的气体。
⑤停止加热(如图,导管出口高于液面)。
⑥测量收集到气体的体积。
⑦准确称量试管和残留物的质量为bg。
⑧测量实验室的温度。
⑨把残留物倒入指定的容器中,洗净仪器,放回原处,把实验桌面收拾干净。
⑩处理实验数据,求出氧气的摩尔质量。
回答下列问题:
(1)如何检查装置的气密性?
(2)以下是测量收集到气体体积必须包括的几个步骤;
①调整量简内外液面高度使之相同;
②使试管和量筒内的气体都冷却至室温;
③读取量简内气体的体积。
这三步操作的正确顺序是: (请填写步骤代号)。
(3)测量收集到气体体积时,如何使量简内外液面的高度相同?
(4)如果实验中得到的氧气体积是c L(25℃、1.0×105Pa)的,水蒸气的影响忽略不计,氧气的摩尔质量的计算式为(含a、b、c,不必化简):
M(O2)=
答案:(1)将导管的出口浸入水槽的水中,手握住试管,有气泡从导管口逸出,放开手后,有少量水进入导管,表明装置不漏气。
(2)②①③
(3)慢慢将量筒下降
(4)
![]()
综上所述,压强差在化学实验中的应用是非常广泛的。应用的正确与否,将直接影响整个实验的成败,同时这一知识点也是对培养学生获取信息、运用知识、分析解决问题、描述论证问题等能力的最好体现。因此在教学中教师必须予以重视,并讲清、讲透。

- 全部评论(0)
