类比推理在高考中的应用
时间:2015-12-12 18:49 来源: 作者:熊振典 点击:次 所属专题: 类比 解题思维
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
对学生思维能力的培养考查一直是近几年高考命题的重要方向,由于化学思维的方式是推理,而中学化学推理的主要形式是逻辑推理和类比推理,因此在高考复习中要将这两种思维能力的培养放在重要位置。笔者在本文中尝试将类比推理在高考中的应用作一简要分析。
类比推理是通过对两个对象(如元素、化合物)的比较,根据它们的某些方面(结构、性质等)的相同或相似之处,推导出它们在其它方面的属性也可能相同的一种论证方法。如凯库勒在研究苯分子的结构时,通过类比(梦中)环状的蛇而得出苯分子的结构是环状的结论。由此可知,类比推理的基础是比较,关键是迁移,所以在化学高考复习中,应根据化学学科特点,掌握好教材中的相关基础知识,熟悉相关元素及其化合物的对应属性,这样,才能进行联想和类比。通过训练,通过对类比推理的运用,有利于培养学生的迁移类推能力,促进学生思维的发展。
通过对近几年高考试题的分析,可归纳出常见的几种类比推理思路。
一、依托元素周期表,寻找类比对象
元素周期表是学习和研究化学的一种重要工具,它是元素周期律的具体表现形式,反映了元素之间的内在联系,体现了“位置—结构—性质”三者的密切关系。过去,化学家门捷列夫曾用元素周期律来预言未知元素并获得了证实,此后,人们又利用它发展物质结构理论,发现和预测新元素的结构和性质,指导工农业生产等,其实这一切,主要应归功于类比推理的充分利用。
由于在化学学习中,我们对某一主族往往详细了解一种有代表性的元素,其余同族其它元素的性质主要通过“位—构—性”三者之间的关系进行类推,以获得对未知元素的了解。类推时应注意相关规律:
1、同周期递变(从左到右):原子半径减小;金属性减弱而非金属性增强。
2、同主族类推(从上到下):原子半径增大;金属性增强而非金属性减弱。
例1:(2002*上海*6)有人认为在元素周期表中,位于ⅠA族的氢元素,也可以放在ⅦA族,下列物质能支持这种观点的是( )
A.HF B.H3O+ C.NaH D.H2O2
解析:氢元素的原子由于易失去一个电子表现出+1价,与碱金属元素性质相似,故排在ⅠA族。如果放在ⅦA族,就应该与卤族元素的性质相似。由卤族元素的性质:最外层有7个电子易得到一个电子而呈-1价。通过类比,氢元素也可得到一个电子而呈-1价(与He电子排布相同)。因此,支持氢元素放在ⅦA族观点的理由是NaH。
二、挖掘新信息,迁移类比推理
中学化学中,教材对具体物质的介绍有限,有很多知识要到更高阶段才能学习,因此,信息题应运而生。通过创设新情景,给出一定信息,要求学生分析。因此,在解题中要学会挖掘新信息,将新知识类比于旧知识,从而构建新的知识体系得以解决新问题。实现这种类比的关键就是联系旧知识,从而发现新情景的生疏知识与熟悉知识本质上的类同性,将解决旧问题的能力迁移到新情景上。
例2:(2002*上海*16)某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液,通电时,为使Cl2被完全吸收制得有较强杀菌能力的消毒液,设计了如图的装置,则对电源电极名称和消毒液的主要成分判断正确的是( )
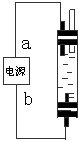
A、a为正极,b为负极;NaClO和NaCl B、a为负极,b为正极;NaClO和NaCl
C、a为阳极,b为阴极;HClO和NaCl D、a为阴极,b为阳极;HClO和NaCl
解析:用石墨作电极电解饱和氯化钠溶液与教材中的氯碱工业原理一致,可以进行类比。氯碱工业电解方程式为:
2NaCl+2H2O![]() Cl2↑+H2↑ +2NaOH,在阳极获得氯气,阴极区域获得氢气和烧碱。由于新信息要求制取家用环保消毒液,通过与漂白粉比较,可知氯气不能直接使用,必须加以转化吸收,这样,产生的氯气只能与阴极区域的烧碱作用生成次氯酸钠溶液。从中推知电源a为负极,b为正极。所以正确答案为B。
Cl2↑+H2↑ +2NaOH,在阳极获得氯气,阴极区域获得氢气和烧碱。由于新信息要求制取家用环保消毒液,通过与漂白粉比较,可知氯气不能直接使用,必须加以转化吸收,这样,产生的氯气只能与阴极区域的烧碱作用生成次氯酸钠溶液。从中推知电源a为负极,b为正极。所以正确答案为B。
三、理解实验原理,学会类比分析
化学实验是化学科学理论产生的源泉和检验标准,化学实验在高考中占有一定比重。近几年实验试题考察的内容是以元素化合物知识为依托,将实验原理、实验现象、基本操作有机地结合起来,出现了一些定性、定量设计简单实验或对提供的实验方案进行评价或改进的试题。故此,要求学生运用实验基本原理,结合题目要求类比教材中的常见实验,找出其相似与相通之处,根据具体物质的性质、答理分析,正确作答。
例3、(2003*理综*33)用下列两种方法可以制得白色的Fe(OH)2沉淀。
方法一:用不含Fe3+的溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时还需加入 。
(2)除去蒸馏水中溶解的O2常采用 的方法。
(3)生成白色的Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是 。
方法二:在如图装置中,用NaOH溶液、铁屑、稀硫酸等试剂制备。
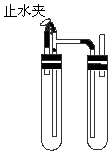
(1)在试管Ⅰ里加入的试剂是 。
(2)在试管Ⅱ里加入的试剂是
(3)为了制得白色Fe(OH)2沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后 的实验步骤是
(4)这样生成的沉淀能较长时间保持白色,其理由是
解析:该题是一个综合性很强的改进实验题。考查了有关氧化还原反应、水解、气体溶解、化学平衡、元素和化合物的性质等基础知识。
关于Fe(OH)2的知识,在教材上有明确的表述和相应实验。对方法一可以回顾教材内容。
方法二可以与方法一进行类比。由于两者的目的一致,都是制备Fe(OH)2,从化学原理看,也都只能用NaOH与可溶性的铁盐,都应防止被空气中的氧气所氧化。
类比1:方法二没有直接给出FeSO4,从原料来看,可用铁屑与稀硫酸反应制备,但反应产生的氢气需作处理。
类比2:法一中通过滴管插入FeSO4溶液液面下,再挤出NaOH溶液防止氧气干扰。从图知,装置内有空气,防止氧气干扰必须排出空气。这样结合类比1,产生的还原性气体排除了装置内的氧气。由气体流向,在试管Ⅰ里加入铁屑与稀硫酸,打开止水夹。
类比3:法2也要加入NaOH,NaOH只能存放在试管Ⅱ中。由于FeSO4与NaOH在不同的试管中,要考虑怎样使两者混合。此时注意Ⅰ中的长导管。当止水夹关闭时,Ⅰ就类似启普发生器(或量气瓶),反应继续产生的气体使Ⅰ中的溶液压入NaOH中,产生Fe(OH)2的白色沉淀。
四、纠正错误类比,形成正确认识
由于类比从本质上讲只是一种推理,而非实验事实,对于其可靠性尚需验证,故在类比中一定要应用物质的相似性,大胆类比,依葫芦画瓢,也要注意到物质的递变性,领悟由于量变而引起质变的规律,更要注意到物质的特殊性,了解是否有这样的性质。因此,一定要掌握好基础知识,及时总结归纳,形成完整的知识体系,从而防止知识的负迁移。
例4:(2000春*京*11)下列对溴化钠的描述中,正确的是( )
A、是一种可溶于水的晶体
B、与硝酸银溶液反应可生成白色沉淀
C、跟浓硫酸反应是制取溴化氢气体的常用方法
D、其工业制法之一是将金属钠跟单质溴反应
分析:A由溶解性规律“钠盐均可溶”类推。B由AgX(X=Cl、Br、I)均不溶,颜色逐渐加深的相似递变判断。C中溴化氢气体与氯化氢类似,都是易挥发物质。氯化氢的制备是氯化钠与浓硫酸反应制备,但不能类推制取溴化氢也用浓硫酸,因为由卤族递变规律,还原性HBr>HCl,所以浓硫酸能氧化溴化氢,要用非氧化性难挥发酸浓磷酸。D类比氯化钠可知不用该法制备。
综上所述,高考复习的目的不仅仅是学会知识“应付”考试,更重要的是在复习中,培养学生思维能力,克服呆板的单一思考。通过诱导学生广泛迁移,类比推理,拓展思维的深度和广度,使学生对不同类知识上挂下连、广泛联系,以实现发展学生智力培养学生能力提高复习效果的目的。

- 全部评论(0)
