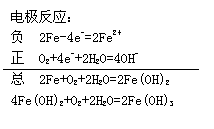电化学中对电极反应式、总反应式书写方法的总结
时间:2016-01-07 19:19 来源: 作者:程新 点击:次 所属专题: 电极反应式
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
在高考复习中,同学们除了重视知识结构的建构以外,还要挖掘规律,抓住关键的知识生长点,进行迁移。在电化学的复习中要紧紧抓住原电池和电解池的本质不同,通过对电极材料和溶液介质情况分析判断后,再书写电极反应式和总反应式。
一、原电池与电解池的区别
装置 | 有无外电源 | 电极材料 | 电极确定 |
原电池 | 化学能→电能 故无外电源 | 活动性不同的金属或一种金属与非金属(或化合物) | 电子流出一极为负极(氧化反应)电子流入一极为正极(还原反应) |
电解池 | 电能→化学能 必有外电源 | 可为惰性电极也可为金属电极(电镀) | 化合价升高一极与电源正极相连(阳极);化合价降低一极与电源负极相连(阴极) |
例1 蓄电池在放电时起原电池的作用,在充电时起电解池的作用。下式是爱迪生蓄电池在放电和充电时发生的反应:
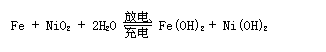
此电池负极上发生反应的物质为 ,充电时阴极发生反应的物质为 。
分析:
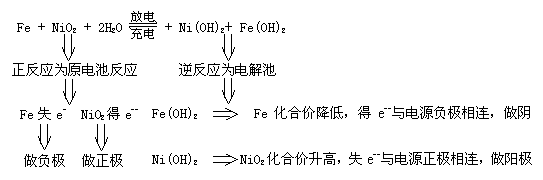
答:Fe;Fe(OH)2
二、原电池的电极反应和总反应式书写方法
方法:第一步确定电极的正、负;第二步根据溶液中离子参加反应情况确定电极反应;第三步将电极反应相加得总反应式。
1.仅有一电极材料参加反应
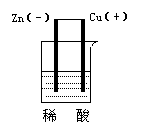
(1)酸性介质
例2
| 电极反应: 负Zn -2e-= Zn2+ 正2H+ + 2e-= H2 总反应式:Zn + 2H+= Zn2++ H2 |
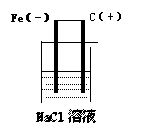
(2)中性介质
例3
|
|
(3)将例3改为碱性介质时与中性介质电极反应式、总反应式一样
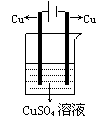
(4) 将例3改为含不活泼金属的盐溶液CuSO4溶液
负极Fe-2e-=Fe2+
正极Cu2++2e-=Cu
总反应式 Fe + Cu2+= Fe2++Cu
2.两电极材料均参与反应
将例1改为写出放电时的电极反应式和总反应式。
分析:正、负极电极反应式书写时,要考虑电解质对电极反应的影响,碱性介质中电极反应两边不能出现H+,电极反应为:
负极 Fe -2e-+2OH-=2Fe(OH)2
正极 NiO2+2H2O+2e-= Ni(OH)2+2OH-
总反应式 Fe+ NiO2+2H2O= Fe(OH)2+Ni(OH)2
3.电极材料本身均不参加反应
例4 飞船上使用的电池是氢氧燃料电池。如图,两电极均由多孔性碳组成。通入气体在电极表面放电,总反应式为 2H2+O2=2H2O 写出酸性和碱性介质中的电极方程式
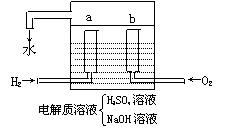
分析:此类电池电极不参加反应,反应的只是燃料,故确定失电子的物质为负极,得电子的物质为正极。书写电极反应要考虑介质;若介质为酸性时反应式两边不出现OH-;碱性介质反应式两边不出现H+。

三、电解池的电极反应和总反应式的书写方法
方法为:第一步:确定电极的材料及阴阳极;第二步:根据溶液中的离子判断电极反应;第三步:将电极反应相加得总反应式。
1. 仅有一个电极参加反应
例5:
| 阳:Cu-2e-= Cu2+ 阴:Cu2++2e-=Cu 总反应式Cu ═ Cu (粗铜)(精铜) |
2.两个电极都不参加反应
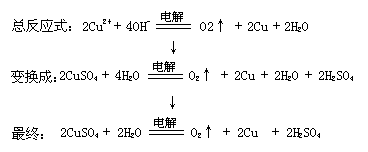
例5中将两个铜电极改为两个惰性电极
阴:2Cu2++4e-=2Cu
阳:4OH--4e-=O2↑+2H2O
3.两个电极都参加反应
例如:例1中充电时书写电极反应式要考虑到反应物、生成物情况及碱性介质中在电极反应式两边不能出现H+,所以阴极与阳极的电极反应式为:
阴极:Fe(OH)2 + 2e-= Fe + 2OH-
阳极:Ni(OH)2 + 2OH- -2=NiO2 + 2H2O
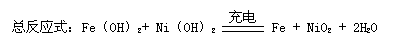
练习:
1.我国首创的以铝—空气—海水电池为能源的新型海水标志灯,它以海水为电解质溶液,利用空气中的氧使铝不断氧化产生电流,写出这种电池的电极材料、电极反应式及总反应式。
答:负极(Al):4Al-12e-=4Al3+
正极(C): 3O2+12e-+6H2O=12OH-
总反应式:4Al+6H2O+3O2=4Al(OH)3
2.熔融盐燃料电池具有高的发电效率,可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为阳极燃气,空气与CO2的混合气为阴极助燃气,制得在650℃下工作的燃料电池。完成有关的电池反应式:
负极反应式:2CO+2CO32--4e-→4CO2
正极反应式:
总反应式:
答:正极:O2+2CO2+4e-=2CO32-
总反应式:2CO+O2=2CO2

- 全部评论(0)