氨的实验室制法及拓展
时间:2016-01-21 14:33 来源:未知 作者:陈螯 点击:次 所属专题: 氨气 实验室制取
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
实验室制备氨气常运用“固固加热法”,具体情况如下:
所用仪器:试管、酒精灯、铁架台、
所用药品:氯化铵晶体、氢氧化钙
反应原理:2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O
实验装置图:(如图所示)
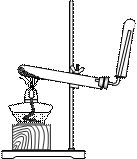
收集方法:只能用向下排空气法。
检验方法:①用湿润的红色石蕊试纸放在试管口,如果湿润的红色石蕊试纸变蓝,则NH3已充满;②用玻璃棒蘸浓盐酸靠近试管口,如果有白烟形成,则说NH3已充满。
干燥:用碱石灰、固体NaOH固体等。
注意事项:①制备氨气可用NH4Cl、NH4SO4等,但不能用NH4NO3和(NH4)2CO3。因为NH4NO3已发生爆炸,(NH4)2CO3与Ca(OH)2生成CaCO3从而阻止Ca(OH)2继续反应。
②消石灰不能用KOH或NaOH代替,原因是KOH、NaOH易吸湿,易结块,不利于产生NH3;高温下易腐蚀试管。
③发生装置中的试管口要向下倾斜,以免产生的水流到试管底部而使试管炸裂。收集气体试管必须干燥,因为氨气易溶于水。
④干燥NH3不能用浓硫酸、五氧化二磷等酸性干燥剂,也不能用中性干燥剂CaCl2(CaCl2+8NH3===CaCl2·8NH3)。
⑤往往在收集气体的试管口放一棉花团,目的是防止与空气形成对流,提高NH3纯度。
该实验的考查点:①实验装置气密性的检验:将导管放在盛水的水槽中,用手握住试管看有没有气泡产生,松开手能不能在导管内产生一段水柱;②收集装置是否充满,即上述检验方法;③装置的安装,大试管关口的倾斜等。
拓展与延伸:
1、实验室也可用如右图装置制取氨气,分液漏斗中盛放浓氨水,烧瓶中盛放NaOH固体。
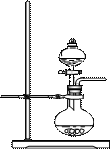
该实验运用“固液不加热”的方法,利用了氨水的性质,
操作简单,已成为考查热点。
原理:浓氨水滴到固体NaOH固体上,一方面固体NaOH溶解放热,温度升高,有利于氨气逸出,另一方面NaOH==Na++OH-,c(OH-)增大,化学平衡NH3+H2O NH3·H2O
NH3·H2O NH4++OH-向逆反应方向移动,有利于NH3逸出。
NH4++OH-向逆反应方向移动,有利于NH3逸出。
2、实验室也可运用加热浓氨水来制取氨气,如图所示,
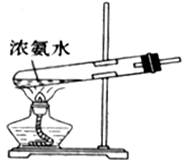
原理:NH3·H2O NH3↑+H2O
NH3↑+H2O
近年来后两种制取方法考查较多,主要出现在综合主观题中,也可以用来综合考查,比如03年上海高考题就对此进行了综合考查:
右图是实验室制取氨气的装置和选用的试剂,其中错误的是( )。
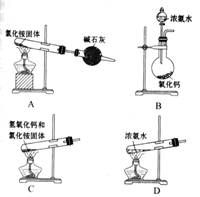
解析:A项,NH4Cl受热分解生成NH3和HCl,冷却后二者又化合生成NH4Cl;B项,CaO+H2O==Ca(OH)2,同时放热,使平衡NH3+H2O NH3·H2O
NH3·H2O NH4++OH-向逆反应方向移动,有利于NH3的产生和逸出;C项,反应原理正确,但试管口应略向下倾斜;D项,浓氨水受热挥发出NH3。
NH4++OH-向逆反应方向移动,有利于NH3的产生和逸出;C项,反应原理正确,但试管口应略向下倾斜;D项,浓氨水受热挥发出NH3。
答案:A、C。
点评:判断实验装置图是否正确的方法
(1)看发生装置是否正确:①实验是否需要加热;②酒精灯加热的部位及先后顺序是否正确;③仪器的放置位置是否合适等。(2)看试剂是否符合反应原理,试剂包括反应物、干燥剂、除杂试剂、尾气吸收剂等。(3)看收集方法是否正确,包括排液法选用的液体试剂、排空气法导管气管伸入的位置等。(4)看是否缺少尾气吸收装置,包括吸收装置中选用的吸收剂是否合适。

- 全部评论(0)
