2025湖北卷化学(2)
时间:2025-06-19 09:06 来源:未知 作者:化学自习室 点击:次 所属专题: 新高考题库
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
【2025湖北等级考】14. 铜(I)、乙腈(简写为L)的某水溶液体系中含铜物种的分布曲线如图。纵坐标(δ)为含铜物种占总铜的物质的量分数,总铜浓度为1.0×10-3mol/L。下列描述正确的是
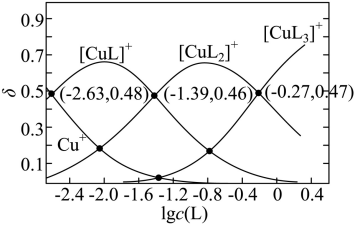
A.Cu++3L [CuL3]+ 的
[CuL3]+ 的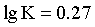
B. 当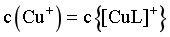 时,
时,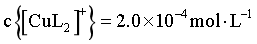
C. n从0增加到2,[CuLn]+结合L的能力随之减小
D. 若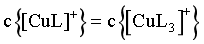 ,则
,则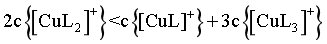
【答案】C
【解析】
【详解】A.Cu++3L [CuL3]+的
[CuL3]+的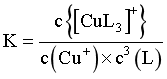 ,当图中
,当图中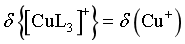 时,
时,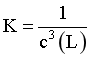 ,
,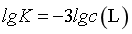 ,由图像可知,此时
,由图像可知,此时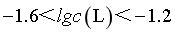 ,则
,则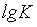 ≠0.27,A错误;
≠0.27,A错误;
B.当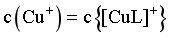 时,由图像可知,
时,由图像可知,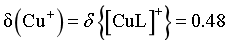 ,
,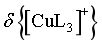 可忽略不计,则,
可忽略不计,则,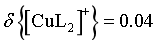 ,
,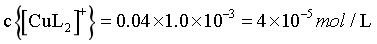 ,B错误;
,B错误;
C.[CuLn]+结合L的离子方程式为[CuLn]++L [CuLn+1]+,当
[CuLn+1]+,当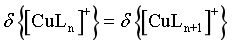 时,
时,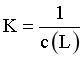 ,由图像交点可知,随着n变大,
,由图像交点可知,随着n变大,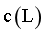 逐渐变大,则K值变小,说明[CuLn]+结合L的能力随之减小,C正确;
逐渐变大,则K值变小,说明[CuLn]+结合L的能力随之减小,C正确;
D.若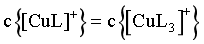 ,由图像交点可知,
,由图像交点可知,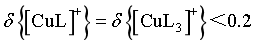 ,
,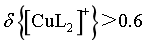 ,则
,则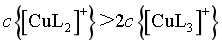 ,故
,故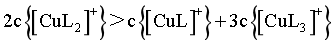 ,D错误;
,D错误;
故选C。
【2025湖北等级考】15. 某电化学制冷系统的装置如图所示。[Fe(H2O)6]3+和[Fe(H2O)6]2+在电极上发生相互转化,伴随着热量的吸收或释放,经由泵推动电解质溶液的循环流动(①→②→③→④→①)实现制冷。装置只通过热交换区域Ⅰ和Ⅱ与环境进行传热,其他区域绝热。下列描述错误的是
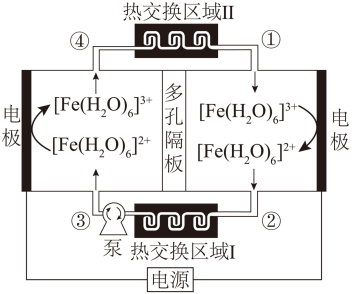
A. 阴极反应为[Fe(H2O)6]3++e- = [Fe(H2O)6]2+
B. 已知②处的电解液温度比①处的低,可推断[Fe(H2O)6]2+比[Fe(H2O)6]3+稳定
C. 多孔隔膜可以阻止阴极区和阳极区间的热交换
D. 已知电子转移过程非常快,物质结构来不及改变。热效应主要来自于电子转移后[Fe(H2O)6]2+和[Fe(H2O)6]3+离子结构的改变
【答案】B
【解析】
【分析】由图可知,左侧电极发生反应[Fe(H2O)6]2+-e- = [Fe(H2O)6]3+,则左侧为阳极,右侧电极反应为[Fe(H2O)6]3++e- = [Fe(H2O)6]2+,则右侧电极为阴极,据此解答。
【详解】A.由分析可知,阴极反应为[Fe(H2O)6]3++e- = [Fe(H2O)6]2+,A正确;
B.已知②处的电解液温度比①处的低,则可推断[Fe(H2O)6]3++e- = [Fe(H2O)6]2+是吸热反应,无法推断[Fe(H2O)6]3+和[Fe(H2O)6]2+的稳定性,B错误;
C.多孔隔膜可以阻止两电极区的溶液对流,可阻止热交换,C正确;
D.题干明确指出电子转移过程非常快,物质结构来不及改变。这意味着电子转移(即氧化还原反应)本身不会直接导致结构变化,热效应实际上来源于电子转移完成后,新生成的离子:[Fe(H2O)6]2+和[Fe(H2O)6]3+因配位环境或电荷分布变化引起的结构重组导致热量变化,D正确;
故选B。
二、非选择题:本题共4小题,共55分。
【2025湖北等级考】16. 氟化钠是一种用途广泛的氟化试剂,通过以下两种工艺制备:
Ⅰ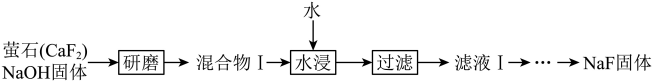
Ⅱ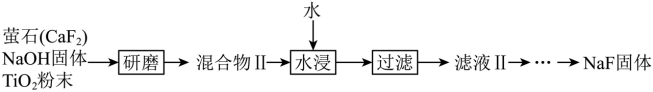
已知:室温下,TiO2是难溶酸性氧化物,CaTiO3的溶解度极低。
20℃时,NaF的溶解度为4.06g/100g水,温度对其溶解度影响不大。
回答下列问题:
(1)基态氟离子的电子排布式为_______。
(2)20℃时,CaF2饱和溶液的浓度为c mol/L,用c表示CaF2的溶度积Ksp=_______。
(3)工艺Ⅰ中研磨引发的固相反应为CaF2+2NaOH=Ca(OH)2+2NaF。分析沉淀的成分,测得反应的转化率为78%。水浸分离,NaF的产率仅为8%。
①工艺Ⅰ的固相反应_______(填“正向”或“逆向”)进行程度大。
②分析以上产率变化,推测溶解度s(CaF2)_______s[Ca(OH)2](填“>”或“<”)
(4)工艺Ⅱ水浸后NaF的产率可达81%,写出工艺Ⅱ的总化学反应方程式_______。
(5)从滤液Ⅱ获取NaF晶体的操作为_______(填标号)。
a.蒸发至大量晶体析出,趁热过滤 b.蒸发至有晶膜出现后冷却结晶,过滤
(6)研磨能够促进固相反应的原因可能有_______(填标号)。
a.增大反应物间的接触面积 b.破坏反应物的化学键
c.降低反应的活化能 d.研钵表面跟反应物更好接触
【答案】(1)1s22s22p6
(2)4c3
(3) ①. 正向 ②. <
(4)CaF2+TiO2+2NaOH=CaTiO3+2NaF+H2O (5)a (6)ab
【解析】
【分析】工艺Ⅰ中研磨引发的固相反应为CaF2+2NaOH=Ca(OH)2+2NaF,水浸后得到滤液Ⅰ主要是NaF、Ca(OH)2溶液,经过系列操作得到NaF固体;
对比两种工艺流程,流程Ⅱ添加TiO2粉末,由题目可知,生成的CaTiO3的溶解度极低,使得Ca2+不转化为Ca(OH)2,提高了NaF的产率,据此解答。
【小问1详解】
氟的原子序数为9,基态氟离子电子排布为1s22s22p6 ;
【小问2详解】
CaF2饱和溶液的浓度为c mol/L,则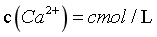 、
、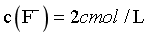 ,
,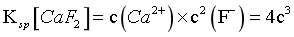 ;
;
【小问3详解】
①转化率为78%,说明固相反应主要向生成Ca(OH)2和NaF的方向进行,即正向进行程度大;
②NaF产率仅为8%,说明大部分NaF未进入溶液,则溶液中存在Ca(OH)2向CaF2的转化过程,根据沉淀转化的规律可推测:s(CaF2)<s[Ca(OH)2] ;
【小问4详解】
根据工艺Ⅱ的流程,CaF2、TiO2与NaOH反应生成难溶的CaTiO3、NaF和H2O,化学方程式为:CaF2+TiO2+2NaOH=CaTiO3+2NaF+H2O;
【小问5详解】
由上一问可知,滤液Ⅱ主要是NaF溶液,因NaF溶解度受温度影响小(题干说明),故蒸发至大量晶体析出,趁热过滤即可得到NaF晶体,故选a;其溶解度随温度变化不明显,冷却结晶无法析出更多晶体,故不选b;
【小问6详解】
a.研磨将固体颗粒粉碎,减小粒径,从而显著增加反应物之间的接触面积,使反应更易发生,a选;
b.研磨过程中的机械力可能导致晶体结构缺陷或局部化学键断裂,产生活性位点,使反应更易发生,b选;
c.活化能是反应固有的能量屏障,研磨主要通过增加接触和产生缺陷来提高反应速率,但一般不直接降低活化能,c不选;
d.研钵仅作为研磨工具,其表面不参与反应,因此与反应物接触更好并非促进反应的原因,d不选;
故选ab。

- 全部评论(0)
