原电池和电解池释疑
时间:2012-03-27 08:45 来源:未知 作者:熊振典 点击:次 所属专题: 电解池 原电池
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
1. 原电池和电解池的判断
判断依据:原电池中发生的是自发进行的氧化还原反应(不需要电源帮助),例如![]() 。电解池中发生的是被迫进行的氧化还原反应(即需要有电源作用才能发生),例如
。电解池中发生的是被迫进行的氧化还原反应(即需要有电源作用才能发生),例如![]() 。下面我们来分析图1装置:
。下面我们来分析图1装置:
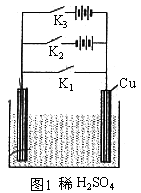
(1)若只闭合K1,其装置为原电池。
正极![]() 负极
负极![]()
总反应![]()
(2)若只闭合K2,其装置成为电解池。
阴极![]() 阳极
阳极![]()
总反应![]()
(3)闭合K3,组成原电池并与电源串联。
正极![]() 负极
负极![]()
总反应![]()
2. 根据原电池原理设计原电池
一般自发进行的氧化还原反应都可以通过原电池来实现。设计原电池一般要考虑三个方面的问题:
①用什么材料作正极;
②用什么材料作负极;
③用什么电解质溶液。
例如,根据![]() 来设计原电池,先把反应拆开为氧化反应和还原反应:
来设计原电池,先把反应拆开为氧化反应和还原反应:
负极:![]() 正极:
正极:![]()
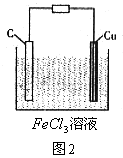
因此,负极用Cu;正极不能用Fe,必须用活泼性比Cu还差的材料,如Pt电极或石墨电极;电解质溶液可用FeCl3溶液,如图2。
3. 由电极反应式过渡到化学方程式
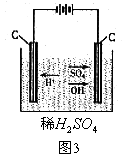
下面我们以电解稀硫酸和NaOH溶液为例来说明此问题。其他由读者举一反三。
如下图3,在稀硫酸中存在![]() 、
、![]() 、
、![]() ,通电后,
,通电后,![]() 向阴极移动并在阴极得到电子被还原生成H2。
向阴极移动并在阴极得到电子被还原生成H2。![]() 和
和![]() 向阳极移动,
向阳极移动,![]() 不失去电子,
不失去电子,![]() 在阳极失去电子被氧化后生成氧气。由于稀硫酸中
在阳极失去电子被氧化后生成氧气。由于稀硫酸中![]() 很少,
很少,![]() 发生氧化反应后,H2O的电离平衡被破坏并向电离方向移动,又电离出
发生氧化反应后,H2O的电离平衡被破坏并向电离方向移动,又电离出![]() 和
和![]() 。故有
。故有
阴极:![]() ① 阳极:
① 阳极:![]() ②
② ![]()
![]()
![]() (向右移动) ③
(向右移动) ③
总反应①+②+③: ![]()
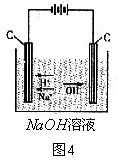
如上图4,在NaOH溶液中存在![]() 、
、![]() 、
、![]() ,通电后,
,通电后,![]() 向阳极移动并在阳极失去电子被氧化生成O2。
向阳极移动并在阳极失去电子被氧化生成O2。![]() 和
和![]() 向阴极移动,
向阴极移动,![]() 不得电子,
不得电子,![]() 得到电子被还原生成H2。由于NaOH溶液中
得到电子被还原生成H2。由于NaOH溶液中![]() 很少,
很少,![]() 发生还原反应后,H2O的电离平衡向电离方向移动,又电离出
发生还原反应后,H2O的电离平衡向电离方向移动,又电离出![]() 和
和![]() 。故有:
。故有:
阳极:![]() ① 阴极:
① 阴极:![]() ②
② ![]()
![]()
![]() (向右移动)③
(向右移动)③
总反应①+②+③:![]()
(责任编辑:化学自习室)

说点什么吧
- 全部评论(0)
(1576117915) 评论 原电池和电解池释疑:感谢作者
(1576117915) 评论 原电池和电解池释疑:感谢作者
(1576117915) 评论 原电池和电解池释疑:感谢作者
还没有评论,快来抢沙发吧!
