原电池中正负极与阴阳极的关系解析
时间:2021-12-21 11:34 来源:未知 作者:王世坤 点击: 次 所属专题: 正负与阴阳
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
阳极(anode)是发生氧化反应的电极。 Anode和cathode是法拉第发明的词,分别用于表示“发生氧化反应的电极”(或者失去电子的电极)和“发生还原反应的电极”(或者接受电子的电极),相当于中文的“阳极”或“氧化极”、以及“阴极”或“还原极”。因此anode与阳极、cathode与阴极是一一对应的。
字典中anode译成“阳极”或者“正极”,cathode译成“阴极”或者“负极”。但是在化学和电学领域,阳极和正极,阴极和负极的概念和原理是有区别的。
在电学和化学领域(电池、电路、阴极射线管等等)中,正极表示电势高的电极,负极表示电势低的电极,分别与英语的positive electrode和negative electrode对应。但是对于阳极和阴极而言,阳极永远发生氧化反应,阴极永远发生还原反应。根据这一规律,进行示意图解分析如下:
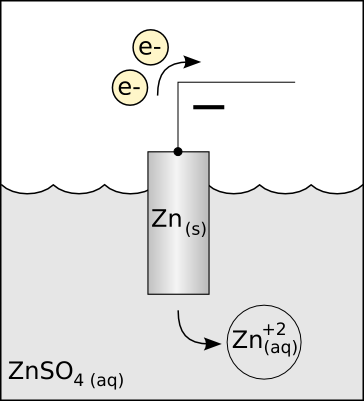
根据电池放电的示意图,图中的电流方向与电子流动方向可以任意设定。在图示的情况下,1端为电子流入的方向,2端为电子流出的方向,相应地,1端为电流流出的方向,2端为电流流入的方向。根据失电子价态升高被氧化、得电子价态下降被还原的原则,以及流出电流则电势高为正极及流入电流则电势低为负极的原则,可以判断1端为正极(电势高)和阴极(被还原),而2端为负极(电势低)和阳极(被氧化)。
根据充电的图示情况,1端为负极,2端为正极。另一方面,由于1端得电子被还原,为阴极,2端失电子被氧化,为阳极。
从以上分析可以看出,在放电时,阳极相当于负极,阴极相当于正极;而在充电时,阳极相当于正极,阴极相当于负极,这是电池领域的一个普遍规律。也就是说,阳极、阴极与电极的正或负没有必然的关系。
(责任编辑:)

说点什么吧
- 全部评论(0)
还没有评论,快来抢沙发吧!
