化学平衡转化率的变化规律及应用
时间:2016-01-08 10:37 来源:河北省新乐市第一中学 作者:陈恒 点击: 次 所属专题: 转化率
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
化学平衡中转化率的变化问题是一个重要的知识点,为便于学生准确掌握,将其变化规律总结如下:
一:温度的影响:
若正反应是吸热反应,升高温度,转化率升高,降低温度,转化率降低;若正反应为放热反应,升高温度,转化率降低,降低温度,转化率升高。
二.压强的影响:
对于mA(g)+nB(g)  pC(g)+qD(g)
pC(g)+qD(g)
1、若m+n>p+q时,压强增大,A、B的转化率升高;压强减小,A、B的转化率降低
2、m+n<p+q时,压强增大,A、B的转化率降低;压强减小,A、B的转化率升高
3、m+n=p+q时,压强变化,A、B的转化率不变。
4.加入惰性气体
如果容器的体积不变(总压强增大)A、B的转化率不变。
如果容器的压强不变(容器的体积增大):
①m+n>p+q时,A、B的转化率降低。
②m+n<p+q时,A、B的转化率升高
③m+n=p+q时,A、B的转化率不变。
三、浓度的影响
对于mA(g)+nB(g)  pC(g)+qD(g)
pC(g)+qD(g)
加A ,A的转化率降低,B的转化率升高
按比例增加A、B:
①m+n>p+q时,A、B的转化率升高。
②m+n<p+q时,A、B的转化率降低。
③m+n=p+q时,A、B的转化率不变。
对于mA(g)  pC(g)+qD(g),加入A:
pC(g)+qD(g),加入A:
①m>p+q时,A的转化率升高。
②m<p+q时,A的转化率降低
③m=p+q时,A的转化率不变。
例1、相同体积的四个密闭容器中,进行同样的四个可逆反应,2A(g)+B(g) 3C(g)+2D(g)起始时各容器中所装A、B的物质的量分别是:
3C(g)+2D(g)起始时各容器中所装A、B的物质的量分别是:
甲容器 | 乙容器 | 丙容器 | 丁容器 | |
A | 2mol | 1 mol | 2 mol | 1 mol |
B | 1 mol | 1 mol | 2 mol | 2 mol |
在相同的温度下建立平衡时,有关A、B转化率的说法正确的是:
(A)A的转化率为:甲<丙<乙<丁
(B)A的转化率为:甲<乙<丙<丁
(C)B的转化率为:甲>乙>丙>丁
(D)B的转化率为:丁>乙>丙>甲
解 析:根据转化率的变化规律:丁中A的转化率最大,甲中转化率最小,丙容器比乙容器物质的量大,相当于丙中的压强大于乙中的压强,因该反应是一个气体体积增 大的反应,所以乙中A的转化率大于丙中A的转化率,即丁>乙>丙>甲;B的转化率用同样的方法确定为:甲>乙>丙> 丁.故正确选项为A、C
例2:完全相同的两个容器A和B,已知A装有SO2和O2各1g ,B中装有SO2和O2各2g ,在相同温度下达到平衡,设A中SO2的转化率为a%,B中SO2的转化率为b%,则A、B两个容器中SO2的转化率的关系是:
(A)a%>b%(B)a%=b%(C)a%<b%
分析:2SO2+O2 2SO3
2SO3
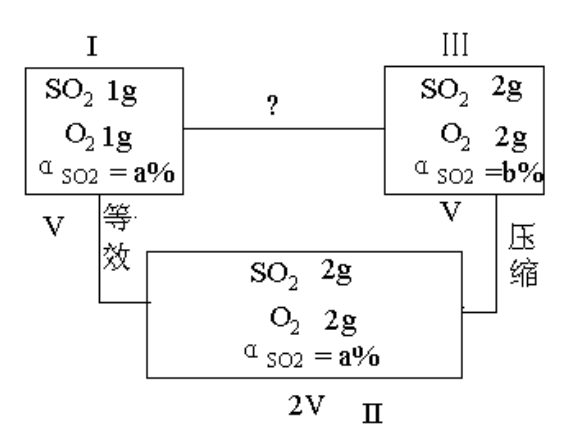
从图中可以看出Ⅰ和Ⅱ属等效平衡,Ⅱ变到Ⅲ需加压,平衡向正反应方向移动,所以,a%<b%

- 全部评论(0)
