强酸、弱酸常见的七种判断方法
时间:2019-11-06 11:21 来源:未知 作者:化学自习室 点击:次 所属专题: 强酸与弱酸比较
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
强酸、弱酸的辨别是中学化学的重要知识 点,也是高考的考点和热点,它涉及到离子方程式的书写、离子共存、pH的求算等多方面内容, 因而必须了解强酸、弱酸常见的七种判断方法。
1、根据化学方程式判断
强酸制弱酸是复分解反应发生的条件之 一,它体现了酸性的相对强弱.如CaCO3 +2HCl=CaCl2 + CO2 + H2O,说明酸性:HCl > H2CO3,H2CO3 是弱酸.
2、根据pH大小判断
(1) 强酸、弱酸电离出H+的程度不同,c(H+)不同,pH也不同,见表1.
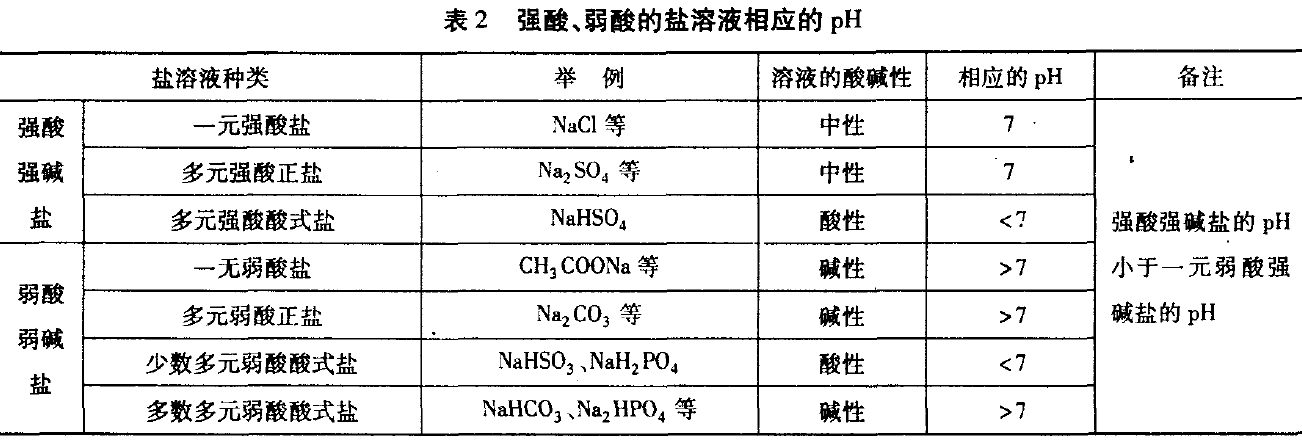
与强碱生成的盐溶液因水解和电离的 程度不一样(强酸强碱盐不水解),溶液的酸碱 性不同,pH也不同,见表2.

3、根据pH变化判断
(1)同pH的强酸、弱酸分别加水稀释相同的倍数,溶液的pH变化大的为强酸,变化小的为弱酸;若pH变化相同时,弱酸加水稀释的量大于强酸。
(2)同pH的强酸、弱酸的稀溶液分别加入少量该酸相应的无水钠盐或钾盐(正盐),pH 变化大的为弱酸,几乎不变的为强酸。
4、根据反应物消耗量判断
(1) pH相同、体积相同的一元酸与碱中 和,消耗碱最多的为弱酸,少的为强酸。
(2)物质的最浓度相同、体积相同的一元 酸与碱中和,消耗碱的量相同时,弱酸盐溶液的 pH大于强酸盐溶液;若反应后溶液呈中性(pH=7),则强酸消耗碱的量大于弱酸。
5、根据生成H2的速率判断
在相同条件下,同浓度的强酸,弱酸与较活 泼金属反应(如Al、Zn等)剧烈程度不一样,生 成比的速率也不一样(直接观察气泡的生成 速率),见表3

6、根据导电性强弱判断
同温度、同物质的量浓度强酸、弱酸溶液, 电离出自由移动离子浓度不同(强酸是完全电 离,弱酸是部分电离),溶液的导电性也不同, 强酸溶液的导电性强于弱酸溶液(可以用电流计测出)。
7、根据中和热大小判断
相同条件下,绝大多数弱酸电离时需要吸 收大量的热量,因此与强碱中和释放出的热量 (又称中和热)小于强酸(可以用量热计测出)_ 如1 L0. 1 mol/L HCl与CH3COOH稀溶液与同 浓度的NaOH溶液中和,测得HCl的中和热所 放出的热量为57. 3 KJ/mol,CH3COOH的中和 热所放出的热量为56.0 KJ/mol。

- 全部评论(0)
