能垒、活化能及化学反应机理
时间:2024-01-02 08:50 来源:未知 作者:化学自习室 点击: 次 所属专题: 活化能 能垒 化学反应机理
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
什么是活化能、能垒?
1、能垒
活化分子含有的能参加化学反应的最低限度的能量,称为化学反应的能垒,或称能阈或能障。
对于一个化学反应,要想从反应物变成产物必须要“翻山越岭”。能垒,则是反应物变成产物所必须克服的能量障碍。能垒的高度表示了反应物转变为产物所需克服的能量障碍的大小,能垒越高,表示反应的难度越大。
能垒大则不易形成活化的中间产物,反应难以进行。能垒E为活化络合物与反应物的零点能之差,是不同于活化能的。一般的化学反应都是在等温等压下进行,自发跟非自发是看delta G也就是吉布斯自由能变。无论哪种,要突破能垒,也就是活化能,都是因为要经历一个过渡态(transient, or say, transition state)。自发跟非自发说的是热力学 (thermodynamics), 活化能高低说的是动力学 (kinetics)。
2、活化能
指分子从常态转变为容易发生化学反应的活跃状态所需要的能量。 对基元反应,反应活化能即基元反应的活化能。对复杂的非基元反应,反应活化能是总包反应的表观活化能,即各基元反应活化能的代数和。
三个版本化学对活化能的表示:
(1)苏教版如图:
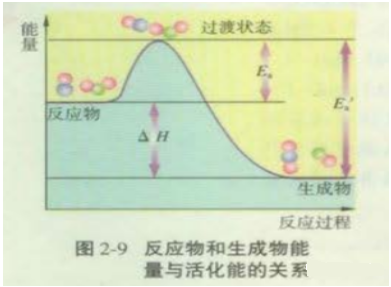
图中:Ea为正反应的活化能,Ea′为逆反应的活化能,
反应热为△H =Ea-Ea′。
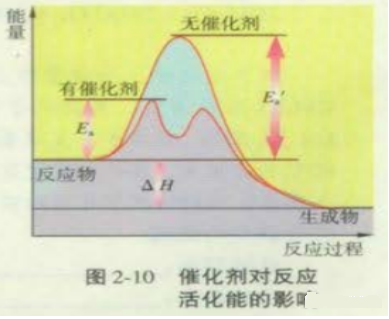
注意:图中使用催化剂时的活化能为Ea1。示意图中有两个峰。
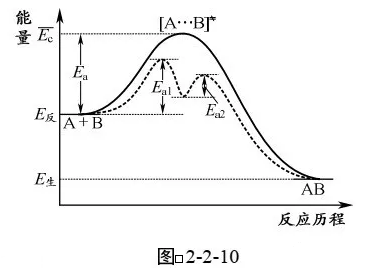
如图2-2-10所示:反应A+B→AB的活化能为瓦,加入催化剂K后,反应分两步进行:
①A+K→AK 活化能为Ea1(慢反应)
②AK+B→AB+K 活化能为Ea2(快反应)
总反应:
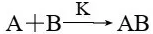
活化能为Eal
可以看出,加入催化剂K后,两步反应的活 化能Eal和Eal均小于原反应的活化能£a,因此反应速 率加快。
仔细分析这两步反应可以看山:由于Ea1>Ea2,第1步反应是慢反应,是决定整 个反应快慢的步骤,称为“定速步骤”或“决速步骤”,第1步反应越快,则整体反应速率就越快。因此对总反应来说,第一步反应的活化能Ea1就是在催化条件下总反应的活化能。
(2)鲁科版及人教版如图:
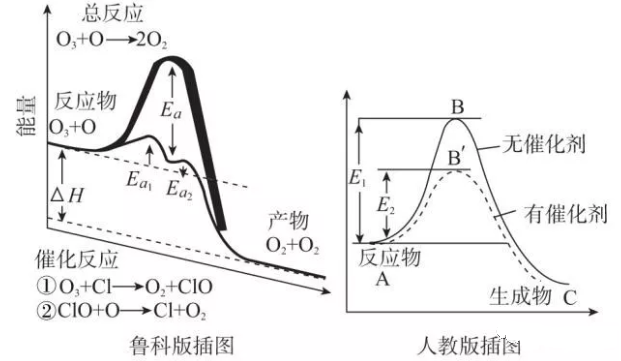
能垒与活化能区别
能垒与活化能的区别:意思不同、反应不同。
1、意思不同。 能垒指的是由于化学反应的成功发生对于反应物到达能量高的过渡态的过程的依赖性而产生的一个“阻碍”,只有一部分有足够能量的分子才能跨越能垒进行反应。
而活化能则是对能垒的一种量化描述,它代表着反应物到过渡态的具体能量差值。也就是,活化能越高,能垒越高,反应速率越慢,反之亦然。
2、反应不同。
能垒:每一个小的分步反应的从较低能量到过渡态所吸收的能量,可以理解成ΔH-t图中“爬坡”的阶段,这些阶段的吸收的能量都是能垒。
活化能:在这个ΔH-t图中,最高点(也就是能量最大的过渡态)到起始点(反应物)所吸收的能量叫做活化能。活化能垒是与初始状态的差值,活化能是与前一个状态的差值。
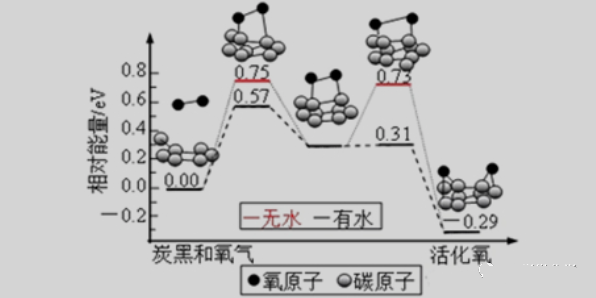
活化能和能垒是化学反应中的两个重要概念。活化能指的是反应进行所需的最小能量,而能至则是指反应势垒,即反应物和产物之间能量差的最大值。
在化学反应中,反应物需要克服一个能垒才能转化成产物。这个能垒就是活化能。化学反应速率则取决于反应物所具有的能量,即活化能。反应物的能量越高,反应速率就越快。
通过降低反应物的活化能,可以加速化学反应的速率。这可以通过加热、加乐或加入催化剂等方式实现。催化剂可以降低反应物的能华,使反应更加容易发生,从而提高反应速率。
因此,了解活化能和能垒的概念对于理解化学反应机理和控制反应速率具有重要意义。
什么是反应机理?
在化学中,反应机理是发生整体化学变化的基本反应的逐步序列。
化学机理是一种理论猜想,它试图详细描述在整个化学反应的每个阶段发生了什么。 在大多数情况下,无法观察到反应的详细步骤。 选择推测的机制是因为它在热力学上是可行的,并且在分离的中间体或反应的其他定量和定性特征方面有实验支持。 它还描述了每个反应性中间体、活化复合物和过渡态,以及哪些键断裂(以及以何种顺序),以及哪些键形成(以及以何种顺序)。 一个完整的机制还必须解释使用反应物和催化剂的原因、在反应物和产物中观察到的立体化学、形成的所有产物以及每种产物的量。
根据机理所包含的基元反应的个数,反应机理分为:有限个或无限个基元反应构成的机理两类。
有限基元反应组成
对峙反应、平行反应和连续反应由有限个基元反应组成的,是常见的反应机理见的反应机理,它们是构成更复杂反应机理的基础模型。举例,如氧化亚氮在碘蒸气存在时的热分解反应:2N2O→2N2+O2。
其反应机理包含以下步骤:

其中,反应(1)是对峙反应,分别用k+和k-表不正向及逆向的反应速率常数。反应(1)、(2)和(3)组成连续反应。因此,这个反应同时具有对峙反应和连续反应的特征。
无限个基元反应组成
链反应属于由无限个基元反应组合而成,像链一样一个接一个传递下去的反应。
链反应有以下三步组成,以H2 + Cl2→2HCl 反应为例,即:
1、链的引发:链反应的开始,自由基在热的作用下分解产生自由基。
即:Cl2→ 2Cl·
2、链的传递:自由基与稳定分子发生作用形成产物,同时又生成新的自由基,反应如同链锁一样连续进行下去。
Cl· + H2→HCl + H·
H· + Cl2→HCl + Cl·
试验证明一个Cl·自由基往往能循环反应生成10~10个HCl分子。
3、链的终止:在链反应进行中,链的传递物在气相中相互碰撞发生重合或歧化形成稳定分子放出能量,也可在气相中或器壁上发生三体碰撞形成稳定分子,而放出的能量被器壁吸收,使链的传递终止。
2 Cl· + M → Cl2 + M
考查方式有哪些?
一、能量反应过程图分析
1.化学动力学与反应历程
化学动力学是研究化学反应进行的速率和反应历程(即机理)的科学。所谓反应历程就是反应物按什么途径,经过哪些步骤,才能转化为最终产物。选择适当的反应途径,可以使热力学由预期转变为现实。
2.基元反应与非基元反应
例如H++OH−=H2O,反应几乎没有过程,瞬间平衡一步到位,称为简单反应;而2HI=H2+I2的实际机理是分两步进行的,每一步都成为一个基元反应,2HI→H2+2I·、2I·→I2存在未成对电子的微粒称为自由基,反应活性高,寿命短,2HI=H2+I2称为非基元反应。
3.有效碰撞理论与活化能
活化能 | 活化分子数 | 单位体积内活化分子数 | 有效碰撞 | |
浓度/压强 | 不变 | 不变 | 上升 | 上升 |
温度 | 不变 | 上升 | 上升 | 上升 |
催化剂 | 下降 | 上升 | 上升 | 上升 |
4.过渡态与中间体
(1)过渡态
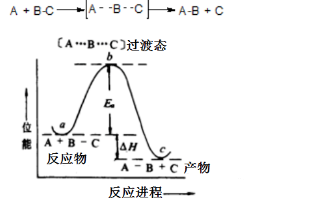
①以上为一种基元反应,其中正反应活化能Ea正=b-a,逆反应活化Ea逆=b-c,ΔΗ=Ea正-Ea逆;②过渡态(A…B…C)不稳定
(2)中间体
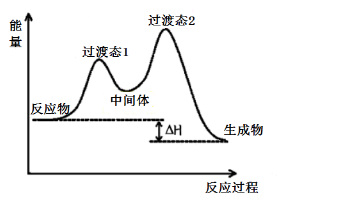
处于能量最高点的是反应的过渡态,在多步反应中两个过渡态之间的是中间体,中间体很活泼,寿命很短,但是比会比过渡态更稳定些。
5.能垒与决速步
能垒:简单可以理解为从左往右进行中,向上爬坡最高的为能垒,而包含此能垒的反应我们称之为决速步骤,也成为慢反应。
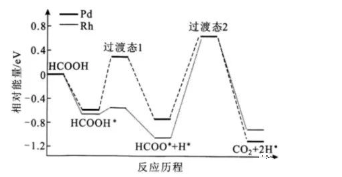
例如下图中,从第一个中间态到过渡态2的能量就是能垒,而HCOO*+H*=CO2+2H*是在Rh作催化剂时该历程的决速步骤。
6.催化剂与中间产物的判断
催化剂:在连续反应中从一开始就参与了反应,在最后又再次生成,所以仅从结果上来看似乎并没有发生变化,实则消耗多少后续又生成了多少。
中间产物:在连续反应中为第一步的产物,在后续反应中又作为反应物被消耗,所以仅从结果上来看似乎并没有生成,实则是生成多少后续又消耗多少。
二、有机反应机理图分析
分析该类题型时
第一,分析题目,看反应物是什么,产物是什么,以及催化剂是什么
第二,分析图表,分析箭头指向,哪些是进入的,哪些是出来的,进入的一般是加入的反应物,出来的是生成物
第三,分析哪些是先生成后消耗,这些往往是中间产物
第四,从历年高考题来看,题目越吓人,看着越难的题,设问或答案往往越简单。
高考中的呈现
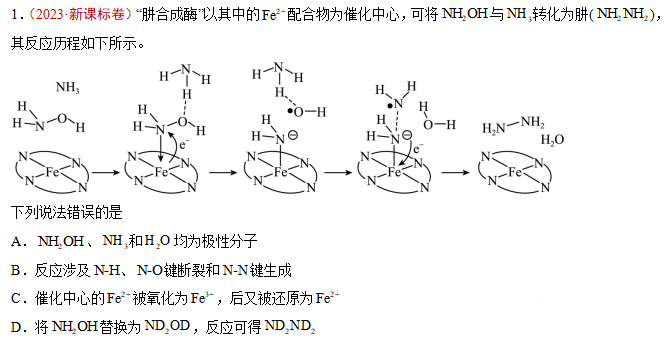
【答案】D
【解析】A.NH2OH,NH3,H2O的电荷分布都不均匀,不对称,为极性分子,A正确;
B.由反应历程可知,有N-H,N-O键断裂,还有N-H键的生成,B正确;
C.由反应历程可知,反应过程中,Fe2+先失去电子发生氧化反应生成Fe3+,后面又得到电子生成Fe2+,C正确;
D.由反应历程可知,反应过程中,生成的NH2NH2有两个氢来源于NH3,所以将NH2OH替换为ND2OD,不可能得到ND2ND2,得到ND2NH2和HDO,D错误;
故选D。
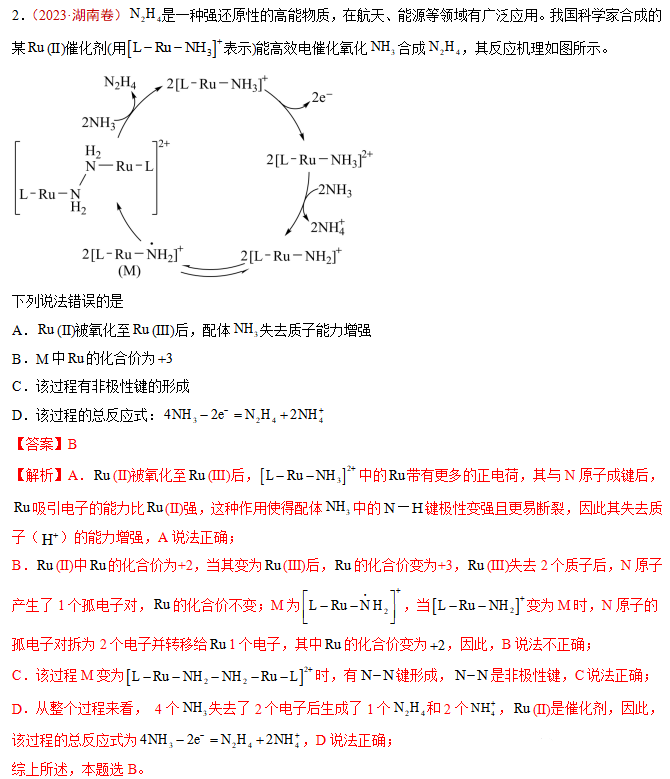
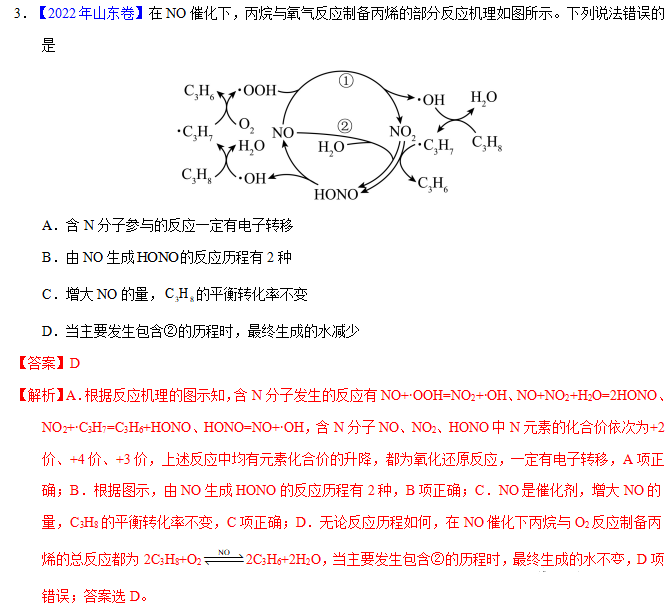
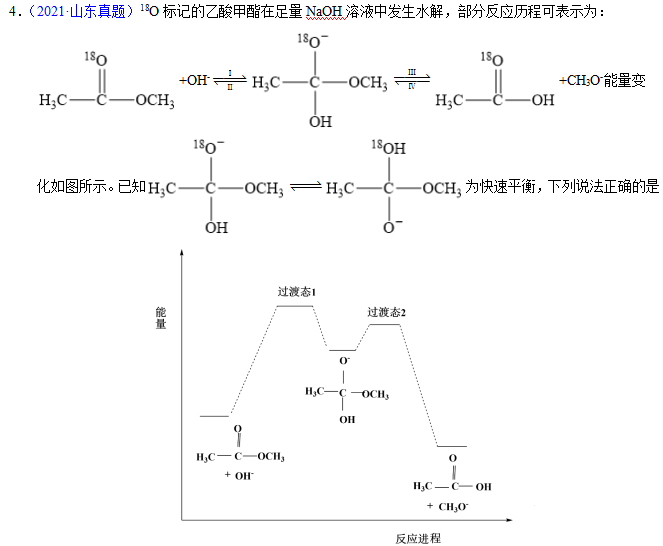
A.反应Ⅱ、Ⅲ为决速步
B.反应结束后,溶液中存在18OH-
C.反应结束后,溶液中存在CH318OH
D.反应Ⅰ与反应Ⅳ活化能的差值等于图示总反应的焓变
【答案】B

- 全部评论(0)
