α-菱形硼(B12)的结构
时间:2019-05-27 08:48 来源:未知 作者:章金莲 点击: 次 所属专题: 硼单质
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
α-菱形硼(B12)的结构呈正二十面体构型,如下图所示:
正二十面体,硼原子占据12个顶点,形成30条棱、20个正三角形
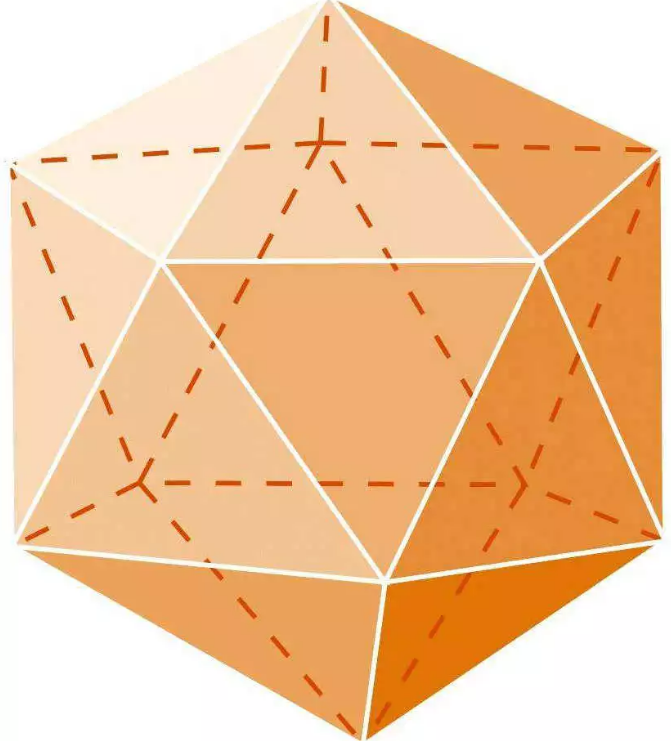
由于硼的缺电子特征,其晶体结构在所有元素中具有最特殊的复杂性。α-菱形硼(B12)的结构单元是正二十面体,形成多中心缺电子键,形成多面体。B12见上图。
价电子数:在B12中,每个硼原子有3个价电子,因此B12中有3× 12 = 36个价电子;
棱数:由于每个B原子与另外5个硼相连,共有5×12/2 = 30条棱;
顶点数:B12正二十面体,12个顶点B原子,12个顶点。
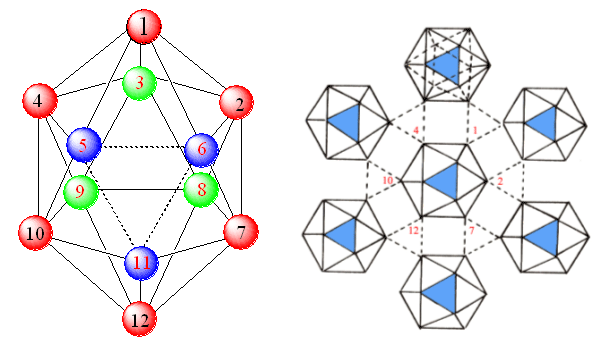
在B12中:36个价电子参与成键情况如下:
(1)腰部:6个B原子(1、2、7、12、10、4)与同一平面内相邻的另6个B12共形成6个3c-2e键,用去6×2/3e = 4e,B-B键的键长为203nm。
(2)顶部和底部:
顶部(3、8、9)和底部(5、6、11)各3个B原子与上一层3个B原子或下一层3个B原子共形成6个正常B-B,共用去6×(2/2)e = 6e,2c-2e键,B-B键的键长为171 nm。
(3)根据多面体顶角规则,由n个顶角形成的多面体中成键轨道为n+1个,可容纳电子数为2n+2,所以在B12中,用于正二十面体形成所需电子数目为13×2=26个。
总的36个电子分配用于内部成键的电子数为26e,与外部B12 成键共用去4e + 6e = 10e。
B12 单元内部成键,由“多面体顶角规则”确定:
多面体顶点数n = 12,成键轨道数 n + 1 = 13, 电子数2n + 2 = 26,总的价电子数:10 + 26 = 36 与B12价电子数一致。
(责任编辑:化学自习室)

说点什么吧
- 全部评论(0)
还没有评论,快来抢沙发吧!
