硼单质及其化合物简介
时间:2021-06-01 09:07 来源:未知 作者:化学自习室 点击: 次 所属专题: 硼及其化合物
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、硼单质
硼的同素异形体
无定形硼 | 晶形硼 |
棕色粉末 | 黑灰色 |
化学活性高 | 硬度大 |
熔点,沸点都很高 | |
1、单质硼的晶体结构

晶体硼(B12结构单元)结构
晶体硼结构单元为正二十面体,12个硼原子占据着多面体的顶点。
2、单质硼的化学性质
2 B + 3F2 = 2 BF3
4 B + 3O2 = 2 B2O3 放出大量热,硼在炼钢过程中作为去氧剂。
B + 6 H2O(g) = 2 B(OH)3 + 3 H2↑
高温下,与N2、S、X2等非金属反应:
2 B+ N2 = 2 BN
2 B + 3Cl2 = 2 BCl3
2 B + 3S =B2S3
无定性硼不与非氧化性酸作用,但与热浓HNO3、热浓H2SO4反应。
B + 3 HNO3(浓)=B(OH)3 + 3 NO2↑
2B + 3 H2SO4 (浓)=2 B(OH)3 + 3 SO2↑
有氧化剂存在时,硼与强碱共熔得到偏硼酸盐。
2B+ 2NaOH+3 KNO3=2 NaBO2+3KNO2+H2O
二、硼的氢化物
最简单的硼烷是 B2H6
1、乙硼烷的制备与性质
Mg3B2+H3PO4 → 硼烷混合物 → B2H6
2BCl3+6H2=6HCl+ B2H6
6LiH + 8BF3=6LiBF4 + B2H6
3NaBh4 + 4BF3=3NaBF4 + 2B2H6
4BCl3+3LiAlH4=LiCl+2 B2H6+3AlCl3
2、乙硼烷的物理性质
无色、难闻的气体或液体
3、乙硼烷的化学性质
很不稳定,在空气中易自燃,热效应很大,可作为高能燃料,但价格昂贵
B2H6(g) + 3O2(g)=B2O3(s) + 3H2O(g) ΔH =-2034 kJ/mol
易被氯气氧化
B2H6(g) + 6Cl2(g)=2BCl3(l) + 6HCl(g)
极易水解
B2H6+6H2O=2H3BO3 + 6H2
有毒
在空气中B2H6的最高允许限量仅为0.1cm3 m-3
2、硼烷的结构
硼的成键特征
(1)共价性
ⅢA中,B的原子半径最小,第一电离能较高,电负性较大,不易失去电子,易形成共价键。
(2)缺电子原子
B 原子轨道:

硼原子的价电子数 成键轨道数硼原子为 “ 缺电子原子 ”
B原子形成共价化合物时只用3对电子,多一个空轨道---“ 缺电子化合物 ”
具有很强的接受电子能力,容易聚合,容易与电子对给予体形成配合物。

三中心两电子氢桥键
氢桥的形成过程:


这种由1个氢原子和2个硼原子共用2个电子构成的键,称“三中心二电子”键,简写为“3C-2E”键,也称为氢桥。
书写:
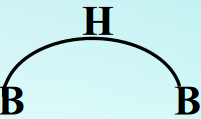
键能比一般共价键小(1/2)
硼烷中有五种键型:
①硼氢键B-H
②硼硼键B-B
③氢桥键

④开放的3中心-2电子硼桥键

⑤闭合的3中心-2电子硼桥键

三、硼的含氧化合物
1、B2O3 和 H3BO3
①B2O3: 是最难结晶的物质之一。
硼酸在红热条件下脱水:玻璃态的 B2O3;在较低的温度下缓慢脱水: B2O3 晶体。
B2O3易溶于水生成硼酸,粉末状的B2O3可用作吸水剂
B2O3+3 H2O=2 H3BO3 (aq)
若水量不充足,如遇到热的水蒸气或潮气时
B2O3 + H2O ( g )=2 HBO2 ( g )偏硼酸
在熔融的条件下,B2O3可与碱性金属氧化物反应生成有特征颜色的偏硼酸盐熔珠:
B2O3+CuO=Cu(BO2)2 (蓝色)
B2O3+Fe2O3=2Fe(BO2)3 (黄色)
②H3BO3:硼酸具有片层状结构,层与层之间以分子间力联系在一起。因此硼酸晶体有解理性,可作为润滑剂。

B:sp2杂化
B(OH)3+H2O=[B(OH)4]-+H+ Ka=5.81×10-10

H3BO3是Lewis酸,是一元酸。
硼酸能与某些多元醇作用,生成较强的酸。
加入的物质可以与B(OH)4-结合成很稳定的物质,用于分析化学中!
2、硼砂及其它硼酸盐

硼砂晶体在空气中易失去水而风化。受热到400 ˚C左右,将失去 8 个结晶水和 2 个羟基水,形成化学式为 Na2B4O7 的无水盐。

①硼砂
化学式:Na2B4O7·10H2O,无色透明晶体,在空气中易风化,加热到878℃,熔化为玻璃状物,此时能溶解许多金属氧化物,生成具有特征颜色的偏硼酸的复盐:
Na2B4O7 + COO =2NaBO2+CO(BO2)2(宝蓝色)
Na2B4O7 + NiO=2NaBO2+Ni(BO2)2(淡红色)
用途:硼砂珠实验(鉴定离子),可用于除氧化物,定性分析,玻璃、陶瓷上釉、制造人造宝石等。
硼砂易溶于水,发生水解而呈碱性:
B4O72-+7H2O 4H3BO3 +2OH-
4H3BO3 +2OH- 2H3BO3 +2B(OH)4-
2H3BO3 +2B(OH)4-
20℃时,硼砂溶液pH值为9.24。
硼砂本身为缓冲溶液,在洗衣粉中作填料。
偏硼酸钠与过氧化氢作用,可以生成过硼酸钠,大量的过硼酸钠被用于洗衣粉中作增白剂。
NaBO2 + H2O2=NaBO3·H2O
工业上可用来制备硼酸
Na2B4O7·10H2O + H2SO4=4H3BO3 + Na2SO4 + 5H2O
H3BO3加热易失水:
H3BO3=HBO2+H2O
4HBO2=H2B4O7 +H2O
H2B4O7=2B2O3+H2O
四、硼的卤化物
BX3的中心硼原子的轨道采用sp2杂化,构型为三角形,为缺电子结构。
BX3 是典型的强的路易斯酸,如:
BF3(g) + NH3=H3N→BF3
BX3水中发生强烈水解:BCl3+3 H2O=B(OH)3+3 HCl
将 BF3 通入水中:BF3+3 H2O=B(OH)3 + 3 HF
进一步反应:BF3 + HF=H+ + BF4-

- 全部评论(0)
