向饱和氢氧化钙溶液中加入生石灰
时间:2017-04-17 10:48 来源:未知 作者:万胜 点击: 次 所属专题: 晶体析出计算 氢氧化钙
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一般情况下,固体物质的溶解度随温度升高而增大,如硝酸钾。但也有极少数固体,如氢氧化钙,它的溶解度却随温度升高反而减小。其溶解度曲线如下图所示:
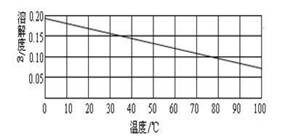
因为氢氧化钙溶解度随温度变化而减小的特殊性,给一些相关问题的解答,带来了思考的难度。
如果我们将一定质量的生石灰加入到一定质量的饱和氢氧化钙溶液中,从开始反应到反应结束的过程中,溶液的温度变化过程是先升高到一定温度后,又恢复到原来温度。在整个变化过程中,溶质的质量、溶剂的质量、溶液的质量、溶液中溶质质量分数、溶液中Ca2+的数目、溶液的pH将如何变化呢?
我们知道,一定温度下,向饱和Ca(OH)2溶液中,加入一定质量的生石灰,生石灰会与溶液中的水发生如下反应:CaO+H2O=Ca(OH)2。因为反应过程中,放出大量的热,使得溶液的温度升高。在整个反应的过程中,因为消耗了部分水,导致溶液中水的质量减少。用图象表示如下图。
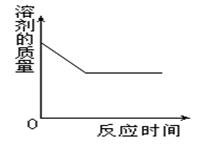
由于溶液中溶剂的减少和溶液温度的升高,导致部分溶质Ca(OH)2析出,使得溶液中溶质的质量出现减少的状况。一会儿之后,随着溶液温度的降低,当溶液温度恢复到原来的温度后,刚刚析出的部分Ca(OH)2还会溶解点,但始终达不到原来的质量。所以,溶液中溶质质量与时间的变化关系可以用图象表示如下图。
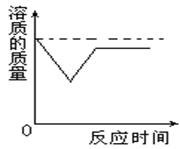
实际上,因为溶液中溶剂的质量与溶质质量的微妙变化,使得溶液的质量也出现了类似的波动,溶液的质量先是减少,然后增加一点点,最后不变。与刚开始比较,所得溶液的质量少于加入生石灰之前溶液的质量。可用图象如右图。
因为溶液的温度变化是先升高后降低,最后恢复到原来温度。所得溶液仍然是原温度下的饱和溶液,所以在整个过程中,溶质质量分数先降低后又升高到原来的数值。表示如下图。
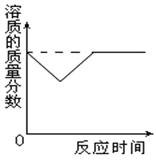
因为溶质质量的减少,溶液中Ca2+的总数也会减少,但溶液中Ca2+的质量分数在变化前后既没有增加,也没有减少,保持不变,所以溶液的碱性强弱不变,也就是说溶液的pH没有变化。
典型例题
1.在25 ℃时,向饱和的澄清石灰水中,加入少量的氧化钙,再恢复到25 ℃,关于该溶液的下列说法中正确的是( )
A.溶液的质量减少
B.溶液的质量不变
C.溶液中溶质的质量分数增大
D.溶液中溶质的溶解度增大
解析:饱和石灰水中加入氧化钙后,氧化钙与水反应导致溶液中溶剂的质量会减少,因此溶解的溶质也会相应的减少,溶液质量也减少。而反应前后溶液的温度不变,所以溶质的质量分数不变,选项A正确。
2.向20 ℃的饱和澄清石灰水(甲溶液)中投入适量的氧化钙粉末,充分反应,下列说法错误的是( )
A.溶液温度末冷却到20 ℃时,溶液一定是饱和溶液
B.溶液温度末冷却到20 ℃时,溶质质量分数比甲溶液大
C.溶液温度恢复到20 ℃时,溶液质量比甲溶液小
D.溶液温度恢复到20 ℃时,溶液的溶质质量分数和甲溶液的相等
解析:向20 ℃的饱和澄清石灰水中加氧化钙,氧化钙与水反应生成氢氧化钙并放热,由于原来溶液就已经饱和,且氢氧化钙的溶解度是温度越高溶解度越小,所以不可能再溶解,不管是没有恢复20 ℃,还是到了20℃,溶液仍然饱和。但在这个过程中,水由于参与反应减少了,即溶剂减少了,溶质肯定相应减少。由于是相同温度下的饱和溶液,溶质质量分数应该相同,选项B错误。

- 全部评论(0)
