关于氢氧化钙的溶解度
时间:2017-04-17 11:16 来源:未知 作者:古盛兰 点击: 次 所属专题: 溶解度 氢氧化钙
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
细腻的白色粉末。相对密度2.24。加热至580℃脱水成氧化钙,在空气中吸收二氧化碳而成碳酸钙。溶于酸、铵盐、甘油,微溶于水,不溶于醇,有强碱性,对皮肤、织物、器皿等物质有腐蚀作用。
水中溶解度随温度升高而降低
0℃ 0.18g 10℃0.17g 20℃0.16g 30℃0.15g 40℃0.14g 50℃0.13g 60℃0.12g 70℃0.105g 80℃0.095g 90℃0.08g 100℃0.07g
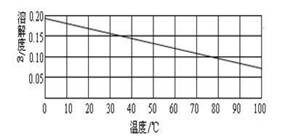
关于Ca(OH)2的溶解度:
系统解释Ca(OH)2的溶解度将在很大程度上超出初中课程的知识范围。离子化合物的溶解可大致分为两个过程。
首先固体离子化合物与水亲和发生溶剂化作用(可简单的认为离子化合物先以“分子”的形式进入溶剂中),然后这些已进入溶剂的“分子”发生电离作用形成离子。
过程2(即电离过程)只能是一个吸热过程(可从系统的电势能的角度分析而知)。而过程1(即溶剂化过程)的热效应却不一定。
我们以固体Ca(OH)2溶于水为例。溶解前的体系是Ca(OH)2固体和纯水。对于过程1:Ca(OH)2(固体) +·nH2O → Ca(OH)2·nH2O(溶液) 的热效应主要取决于Ca(OH)2是否与水作用形成配合物即Ca(OH)2·nH2O的形式(n(的值取决于钙元素的空电子轨道数目和其他外部条件如温度条件等))。事实上Ca(OH)2是能和水形成配和物的。而形成配合物的过程是一个放热过程。
形成的配合可以发生过程2(即电离过程):Ca(OH)2·nH2O → Ca(H2O )n2++ 2 OH-,由于钙元素与水分子的配合过程的放热效应很大,它包含于过程1中,超过了过程1与过程2中其它有热效应的过程的影响,故Ca(OH)2的溶解过程总的热效应是放热。温度升高将会使溶解平衡过程向相反方向移动,故而Ca(OH)2的溶解度随温度升高而减小。体系在溶解前后总的能量比较是溶解前大于溶解后。多余的能量以热能的形式放出。
而对于NaOH来说,它的过程1的热效应也是放热,但其机理却截然不同,主要是由于破坏了NaOH固体中具有较高能量的晶形结构,而不是形成配合物。这个破坏过程由于其不可逆转性而无法决定平衡的动向。但过程2始终是吸热的,所以NaOH固体的溶解度随温度升高而增大。这样就可以解释为何NaOH固体溶解时放热而它的溶解度却随温度升高而增大。

- 全部评论(0)
(2958550638) 评论 href="/plus/view.php?aid=12069">关于Ca(OH)2 的溶解度:三二一一二三
