硅烷
时间:2012-05-14 17:09 来源:未知 作者:徐俊龙 点击: 次 所属专题: 硅烷
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
通式SinH2n+2的一类硅的氢化物。已知的有SiH4、Si2H6、Si3H8、Si4H10、Si5H12和Si6H14六种直链的或支链的氢化硅。前四种的物理性质见表。
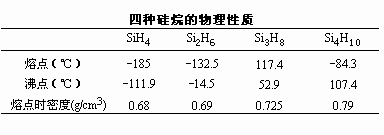
硅烷的热稳定性随着分子中硅原子的增多而迅速降低。SiH4和Si2H6在400℃时开始分解,Si4H10在室温时已明显分解,Si6H14的分解速率更快。
硅烷在空气中可燃烧,生成SiO2和H2O;与卤素单质作用生成卤代硅烷,在催化剂存在下能与卤化氢作用生成卤代物。例如:
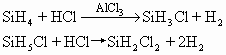
硅烷能被水分解,在微量酸或碱存在下反应速率加快:
SiH4+2H2O→SiO2+4H2
硅烷与醇类反应,生成硅酸酯;在一些有机溶剂中或液氨中还能与碱金属、碱金属的氢化物和烷基化物进行置换或复分解反应。此外,硅烷在催化剂存在下,还能与氯仿发生氢和氯的对换作用。
硅烷最早是用硫酸或磷酸水解硅化镁Mg2Si来制备,产品是一种硅烷混合物。后来逐渐利用氢化铝锂与卤化硅在乙醚中反应来制备:
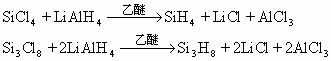
硅烷中的甲硅烷较重要,是热分解法制取超纯硅,生产半导体硅的原料。
(责任编辑:化学自习室)

说点什么吧
- 全部评论(0)
还没有评论,快来抢沙发吧!
