浅谈用“ΔG =ΔH-TΔS”对反应产物的分析
时间:2023-02-26 17:59 来源:未知 作者:代鹏 点击: 次 所属专题: 吉布斯自由能 反应方向
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
1、焦炭在高温下与水蒸气的反应。
本反应的主要产物是CO和H2,并非CO2和H2。
由于化学反应C(s)+H2O(g)=CO(g)+H2(g)的ΔHθ=﹢132kJ/mol、ΔGθ=﹢91kJ/mol、ΔSθ=﹢133J/(K·mol),由ΔGθ=﹢91kJ/mol>0可知反应不能自发正向进行,把相关数据代入ΔGθ=ΔHθ-TΔSθ计算后知:只要T>992.48K,就会正向反应;虽反应CO(g)+H2O(g)=CO2(g)+H2(g)的ΔGθ=﹣29kJ/mol<0,反应可能自发正向进行,但在T>992.48K时,把该反应的相关数据代入ΔGθ=ΔHθ-TΔSθ计算后知,ΔGθ=﹢1.68kJ/mol>0,所以在992.48K条件下此反应不能正向进行。所以综合起来,焦炭在T>992.48K的高温下与水蒸气反应的主要产物应是CO和H2,而非CO2和H2。
2、工业制硅。
碳在高温条件下还原二氧化硅制粗硅时产物为何是CO而非CO2?
通过把反应式SiO2+2C Si+2CO↑和SiO2(s)+2C(s)=Si(s)+2CO(g)的相关数据代入ΔGθ=ΔHθ-TΔSθ计算就可知。因反应SiO2+2C
Si+2CO↑和SiO2(s)+2C(s)=Si(s)+2CO(g)的相关数据代入ΔGθ=ΔHθ-TΔSθ计算就可知。因反应SiO2+2C Si+2CO↑的ΔGθ=﹢582.7kJ/mol>0,此反应在常温下不能正向进行;把相关数据代入ΔGθ=ΔHθ-TΔSθ计算知,当T>1767K时反应就会正向自发进行;同样把反应SiO2(s)+C(s)=Si(s)+CO2(g)的相关数据代入计算也知,要T>2521.42K时反应才能正向自发进行。纵观两者反应温度可知其相差754℃,从工业化生产角度来看将SiO2跟C反应生成CO比生成CO2要节约成本,生成CO才符合工业生产实际。另外,许多人也认为C在高温的情况下会与CO2反应生成CO,所以即使反应中生成了CO2,也会在高温下与C重新反应生成CO,故反应体系中不存在CO2,而只有CO产生并存在。但我认为第一种分析更科学。
Si+2CO↑的ΔGθ=﹢582.7kJ/mol>0,此反应在常温下不能正向进行;把相关数据代入ΔGθ=ΔHθ-TΔSθ计算知,当T>1767K时反应就会正向自发进行;同样把反应SiO2(s)+C(s)=Si(s)+CO2(g)的相关数据代入计算也知,要T>2521.42K时反应才能正向自发进行。纵观两者反应温度可知其相差754℃,从工业化生产角度来看将SiO2跟C反应生成CO比生成CO2要节约成本,生成CO才符合工业生产实际。另外,许多人也认为C在高温的情况下会与CO2反应生成CO,所以即使反应中生成了CO2,也会在高温下与C重新反应生成CO,故反应体系中不存在CO2,而只有CO产生并存在。但我认为第一种分析更科学。
3、氨气的催化氧化产物。
氨气在Pt~Rh合金作催化剂且加热的条件下,氧气反应生成NO和H2O,产物中应是NO而非NO2。
从反应4NH3(g)+5O2(g)=4NO(g)+6H-2O(g)中的ΔHθ=﹣905.96kJ/mol和ΔGθ=﹣955.6kJ/mol可知,此反应在常温下虽能正向自发进行,但为了降低反应所需要的能量和反应物的活化能,同时提高反应速率,生产实际中却选择在“Pt~Rh合金作催化剂和温度约1273K”的条件下进行。把反应2NO2(g)=2NO(g)+O2(g)的相关数据代入ΔGθ=ΔHθ-TΔSθ计算后知,在T>788.8K时此反应就会自发正向进行,即当T>788.8K时NO2就会自行分解为NO和O2。而氨与氧气发生反应后,体系的温度会高于788.8K,此时体系中即使存在NO2也会自行分解成NO和O2的,所以反应产物中不应有NO2。所以氨气的催化氧化方程式应为:4NH3+5O2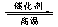 4NO+6H2O。
4NO+6H2O。

- 全部评论(0)
