用石墨电解CuSO4的和NaCl混合液的pH变化
时间:2012-10-22 11:01 来源:未知 作者:爱莉 点击: 次 所属专题: 连续电解
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
先看原题:将等物质的量浓度CuSO4的和NaCl溶液等体积混合后,用石墨电极进行电解,电解过程中,溶液PH随时间t变化走势为:
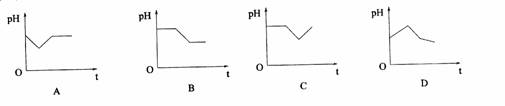
答案为:D
解析:等物质的量浓度CuSO4的和NaCl溶液等体积混合,可以设CuSO4的和NaCl各1mol, 电解分3个阶段:
第一阶段 阳极:1mol氯离子失1mol电子 阴极:1/2 mol铜离子得1mol电子。电解的实质是电解了氯化铜,氯化铜溶液因为水解呈酸性,电解后浓度减小了,所以酸性减弱,PH值增大
第二阶段 阳极:1mol氢氧根离子失1mol电子(来源于水的电离) 阴极:1/2 mol铜离子再得1mol电子 因为氢氧根离子消耗,使水溶液中氢离子浓度增大,PH值迅速减小
第三阶段 阳极:氢氧根离子失电子 阴极:氢离子得电子 他们都来源于水的电离,但过程中水消耗了,使溶液中氢离子浓度增大,PH值减小
(责任编辑:化学自习室)

说点什么吧
- 全部评论(0)
还没有评论,快来抢沙发吧!
