研究有机化合物的一般步骤和方法
时间:2012-11-23 15:48 来源:未知 作者:熊振典 点击: 次 所属专题: 有机物研究方法
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
从天然资源中提取有机物成分,首先得到的是含有有机物的粗品。在工厂生产、实验室合成的有机化合物也不可能直接得到纯净物,得到的往往是混有未参加反应的原料,或反应副产物等的粗品。因此,必须经过分离、提纯才能得到纯品。如果要鉴定和研究未知有机物的结构与性质,必须得到更纯净的有机物。下面是研究有机化合物一般要经过的几个基本步骤:

一、分离、提纯
提纯混有杂质的有机物的方法很多,基本方法是利用有机物与杂质物理性质的差异而将它们分离。接下来我们主要学习三种分离、提纯的方法。
1、蒸馏
所用仪器:铁架台(铁圈、铁夹)、酒精灯、石棉网、蒸馏烧瓶、温度计、冷凝管、接受器等。如图所示:
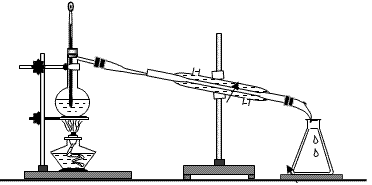
特别注意:冷凝管的冷凝水是从下口进上口出。
2、结晶和重结晶
(1)冷却法:将热的饱和溶液慢慢冷却后析出晶体,此法适合于溶解度随温度变化较大的溶液。
(2)蒸发法:此法适合于溶解度随温度变化不大的溶液,如粗盐的提纯。
(3)重结晶:将已知的晶体用蒸馏水溶解,经过滤、蒸发、冷却等步骤,再次析出晶体,得到更纯净的晶体的过程。
重结晶的首要工作是选择适当的溶剂,要求该溶剂:(1)杂质在此溶剂中的溶解度很小或溶解度很大,易于除去;(2)被提纯的有机物在此溶剂中的溶解度,受温度的影响较大。
3、萃取
(1)所用仪器:烧杯、漏斗架、分液漏斗。
(2)萃取:利用溶液在互不相溶的溶剂里溶解度的不同,用一种溶剂把溶质从它与另一种溶剂组成的溶液中提取出来,前者称为萃取剂,一般溶质在萃取剂里的溶解度更大些。
分液:利用互不相溶的液体的密度不同,用分液漏斗将它们一一分离出来。
【注意】
1、萃取剂必须具备两个条件:一是与溶剂互不相溶;二是溶质在萃取剂中的溶解度较大。
2、分液时,打开分液漏斗的活塞,将下层液体从漏斗颈放出,当下层液体刚好放完时,要立即关闭活塞,上层液体从上口倒出。
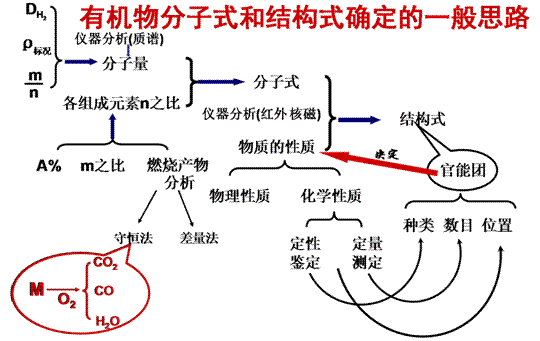
二、元素分析与相对分子质量的测定
1、元素分析
元素定量分析的原理是将一定量的有机物燃烧,分解为简单的无机物,并作定量测定,通过无机物的质量推算出组成该有机物元素原子的质量分数,然后计算出该有机物分子所含元素原子最简单的整数比,即确定其实验式。以便于进一步确定其分子式。
有机物的分子式的确定方法有很多,在今后的教学中还会进一步介绍。今天我们仅仅学习了利用相对分子质量和实验式共同确定有机物的基本方法。应该说以上所学的方法是用推算的方法来确定有机物的分子式的。在同样计算推出有机物的实验式后,还可以用物理方法简单、快捷地测定相对分子质量,比如——质谱法。
2、相对分子质量的测定——质谱法
质谱是近代发展起来的快速、微量、精确测定相对分子质量的方法。
(对质谱法的原理,怎样对质谱图进行分析以确定有机物的相对分子质量,以及此方法的优点作简要精确的了解)
通过测定,已经知道了该有机物的分子式,但是我们知道,相同的分子式可能出现多种同分异构体,那么,该如何进以步确定有机物的分子结构呢?下面介绍两种物理方法。
三、分子结构的鉴定
1、红外光谱
介绍红外光谱法鉴定分子结构的原理,对红外光谱图的正确分析,最终确定有机物的分子结构。
2、核磁共振氢谱
介绍核磁共振氢谱法鉴定分子结构的原理,对核磁共振氢谱图的正确分析,最终确定有机物的分子中所含H原子的种类和个数。
总结:
【经典例题】
例1、某烃含氢元素的质量分数为17.2%,求此烃的实验式。又测得该烃的相对分子质量是58,求该烃的分子式。
【分析解答】分析:此题题给条件很简单,是有机物分子式确定中最典型的计算。由于该物质为烃,则它只含碳、氢两种元素,则碳元素的质量分数为(100-17.2)%=82.8%。则该烃中各元素原子数(N)之比为:
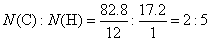
C2H5仅仅代表碳原子和氢原子的最简整数比,是该烃的实验式,不是该烃的分子式。
设该烃有n个C2H5,则
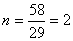
因此,烃的分子式为C4H10。
例2、在标准状况下,某气态烃112ml,燃烧后生成CO2和水蒸气的体积比是3∶4,把燃烧产物通过碱石灰,碱石灰增重1.02g。求气态烃的分子式。
解: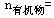
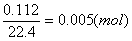
碱石灰既吸收水又能吸收CO2,故1.02g为生成的CO2和H2O的质量之和。
因为,同温同压下,
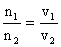
设生成 CO2为3xmol,H2O为4xmol。
44×3x+18×4x=1.02 解得
x=0.005(mol)
所以, n有机物∶nCO2∶nH2O=1∶3∶4
即1mol该烃分子中含3molC,8molH。此烃分子式为C3H8。
例3、燃烧某有机物A 1.50g,生成1.12L(标准状况)CO2和0.05mol H2O。该有机物的蒸气对空气的相对密度是1.04,求该有机物的分子式。
解答:首先要确定该物质的组成元素。
1.5g
A中各元素的质量:
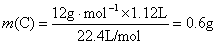
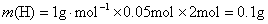
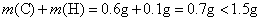 ,所以有机物中还含有O元素。
,所以有机物中还含有O元素。
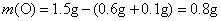
则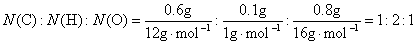
实验式为CH2O,其式量为30。
又因该有机物的相对分子质量M(A)=1.04×29=30
因此实验式即为分子式。

- 全部评论(0)
(2178286059) 评论 href="/plus/view.php?aid=13438">研究有机化合物的一:非常感谢啊啊啊,有个小错误,蒸馏那个温度计应该在支管口处
(2178286059) 评论 href="/plus/view.php?aid=13438">研究有机化合物的一:非常感谢啊啊啊,有个小错误,蒸馏那个温度计应该在支管口处
(1775890058) 评论 href="/plus/view.php?aid=13438">研究有机化合物的一:最主要的是方法
(2934295592) 评论 href="/plus/view.php?aid=13438">研究有机化合物的一:蒸馏那个图,温度计底部不能插入液面以下,应该插在蒸馏烧瓶
(8955125568) 评论 href="/plus/view.php?aid=13438">研究有机化合物的一:我在外面吃药了吗呢啊
