酸碱盐学习中的“12345”
时间:2016-01-17 14:32 来源:江苏省邳州市运河中学 作者:王兵 点击: 次 所属专题: 酸碱盐
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
摘要:一个原则─-交换的原则,1个规律─-“成盐”的规律;两类反应条件─-置换反应和复分解反应的条件;三类物质的性质─-根据成盐规律可推出酸、碱、盐的化学性质;四类能溶于水的物质─-钾、钠、铵、硝的化合物;五类物质─-单质、氧化物、酸、碱、盐的相互关系。
又到了学习酸碱盐的时候,又到了学生学习化学感觉最难的时候,你是否感觉教完或学完了酸碱盐后学生总记不住酸碱盐有哪些化学性质?很多方程式都不知怎么写?什么题都难?错的也是一塌糊涂?是的,酸碱盐不好学,有句话叫做“学好酸碱盐,化学就不难”!
酸碱盐的学习真的这么难吗?其实不然!之所以感觉到难,那是因为不知道学习酸碱盐的方法和规律。比如,酸碱盐之间的化学反应方程式是绝不要死记硬背的,按照一定的规律和方法是很容易写的,被称为傻瓜式的反应方程式,即傻瓜都会写!还难吗? 那么,怎么样才能写好方程式,怎样才能学好酸碱盐呢?
下面的“1、2、3、4、5”或许对你有所启发。
一、1个原则─-交换的原则:
(一)、直接交换
酸碱盐所发生的反应几乎都是置换反应或者是复分解反应,不论是置换反应还是复分解反应都是位置的交换。如:
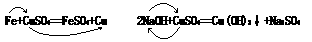
再如例1:下列反应的方程式都很重要,交换一下就写出来了。
①锌和稀硫酸 ②氧化铁和盐酸 ③氯化钠和硝酸银④硫酸钠和氯化钡 ⑤碳酸钠和盐酸 ⑥碳酸钠和石灰水⑦石灰水和硫酸铜 ⑧氢氧化钡和硫酸 ⑨氢氧化钠和硫酸铵共热
即:① 实验室制取氢气:Zn+H2SO4=ZnsO4+H2↑
②除铁锈:Fe2O3+6HCl=2FeCl3+3H2O
③检验Cl-离子:NaCl+AgNO3=AgCl↓+NaNO3
④检验SO4-离子:Na2SO4+BaCl2=BaSO4↓+2NaCl
⑤检验CO32-离子:Na2CO3+2HCl=2NaCl+H2O+CO2↑
⑥纯碱制烧碱:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
⑦波尔多液的反应:Ca(OH)2+CuSO4=Cu(OH)2↓+CaSO4
⑧重要的中和反应:Ba(OH)2+H2SO4=BaSO4↓+2H2O
⑨检验NH4+离子:2Na0H+(NH4)2S04 Δ Na2SO4+2H2O+2NH3↑
(二)、非直接交换 有些反应可理解成先化合后再交换。
如:氢氧化钠溶液和二氧化碳的反应
可理解为:CO2 + H2O = H2CO3
2NaOH+H2CO3=Na2CO3+2 H2O![]()
CO2+2NaOH==Na2CO3+H2O
再如例2:写下列反应的方程式:①氢氧化钙和二氧化碳②氢氧化钾和二氧化碳 ③氢氧化钠二氧化硫④氢氧化钠和三氧化硫
解答:①CO2+Ca(OH)2=CaCO3↓+H20 ②CO2+2KOH=K2CO3+H2O
因为S02+H2O=H2SO3 S03+H2O=H2SO4 所以:③SO2+2NaOH=Na2SO3+H2O④SO3+2NaOH=Na2SO4+H2O
1个规律─-“成盐”的规律
观察以上的酸碱盐的反应,都符合“成盐”的规律:即有酸、碱、盐参加的反应往往都会生成盐。否则就是错误的。如:2NaOH+CuO≠Cu(OH)2↓+Na2O 可以理解为就是因为没有盐生成,才不反应的。2NaOH+Al2O3==2NaAlO2(偏铝酸钠)+H2O有盐生成,所以能反应。根据:“金属离子+酸根—组成→盐” 就可以推出酸、碱、盐等的化学性质(“3”中将会详细地说明)。
二、两类反应条件
依据:金属活动性顺序表:K Ca Na Mg Al Zn Fe Sn Pd (H) Cu Hg Ag Pt Au
可用谐音趣味记忆法记: 嫁给那美女,心铁(了)喜欠情,(欠了多少?)统共一百斤
(一)、置换反应的条件
1:金属+酸 的反应条件:氢前金属、非氧化酸(如:硝酸、浓硫酸具有氧化性,不生成氢气),铁生成亚铁盐。
如例3:下列物质间能否反应生成氢气?能反应的写出方程式,不能反应的说明理由。
①Fe+HCl= ②Cu+H2SO4= ③ Fe+2HNO3=
解答:①能 Fe+2HCl=FeCl2+H2↑②Cu在H后不反应③HNO3有氧化性不生成氢气
2:金属+盐的反应条件:前置后,盐须溶,K Ca Na(太活泼,能和水反应)不能行。
如例4:下列物质间能否反应置换出金属?能反应的写出方程式,不能反应的说明理由。
①Fe+CuSO4= ②Cu+ZnsO4= ③Cu+AgCl= ④Na+CuSO4=
解答:①Fe+CuSO4=Cu+FeSO4 ②Cu+ZnsO4≠因为Cu没有Zn活泼③Cu+AgCl≠因为AgCl不溶于水
④2Na+CuSO4≠Cu+Na2SO4 因为:2Na+2H2O=2NaOH+H2↑ 2NaOH+CuSO4=Cu(OH)2↓+Na2SO4
(二)、复分解反应的条件
口诀:双交换,价不变,生成气体、水、沉淀;盐-盐、盐-碱须可溶,弱酸制强不能行。
如例5:下列物质间能否反应?能反应的写出方程式,不能反应的说明理由。
①Fe2O3+H2SO4= ②Ca(OH)2+Na2CO3= ③KOH+Na2CO3=
④BaCO3+Na2SO4= ⑤Cu(OH)2+Fe2(SO4)3= ⑥CaCl2+H2CO3=
解析:①Fe2O3+3H2SO4=Fe2(SO4)3+3H2O ②Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
③2KOH+Na2CO3≠2NaOH+K2CO3 无气体、水、沉淀生成
④BaCO3+Na2SO4≠BaSO4↓+Na2CO3 BaCO3不溶于水
⑤3Cu(OH)2+Fe2(SO4)3≠3CuSO4+2Fe(OH)3↓ Cu(OH)2不溶于水
⑥CaCl2+H2CO3≠CaCO3↓+2HCl 因为:CaCO3+2HCl=CaCl2+H2O+CO2↑
三、三类物质的化学性质
(一)酸
因为酸含有酸根,要想“成盐”必须和含金属元素的物质反应才行,所以酸的化学性质都和金属有关:
1、酸溶液能使紫色石蕊变红,无色酚酞不变色
2、酸+活泼金属→盐+H2 H2SO4+Mg=MgSO4+H2↑
3、酸+金属氧化物→盐+水 3H2SO4+Fe2O3=Fe2(SO4)3+3H2O
4、酸+碱(金属+OH根)→盐+水 3H2SO4+2Al(OH)3=Al2(SO4)3+6H2O
5、酸+盐(金属+酸根)→盐+酸 HCl+AgNO3=AgCl↓+HNO3
(二)碱
因为碱中含有金属离子,要想“成盐”必须和含酸根或能形成酸根(如非金属氧化物甚至金属氧化物)的物质反应生成盐。所以酸的化学性质都和酸根有关:
1、碱溶液能使紫色石紫变蓝,使无色酚酞变红。
2、碱+非金属氧化物→盐+水 2NaOH+Si02=Na2Si03+H20
3、碱+酸→盐+水 NaOH+HCl=NaCl+H20
4、碱+盐→新碱+新盐 Ba(OH)2+Na2CO3=2NaOH+BaCO3↓
(三)盐
因为盐中既有金属离子又有酸根离子,所以盐既能和含酸根又能和含金属元素的物质反应生成盐。
1.盐+金属→盐+金属 2AgNO3+Cu=2Ag+Cu(NO3)2
2.盐+酸→新盐+新酸 Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
3.盐+碱→新盐+新碱 FeCl3+3NaOH=3NaCl+ Fe(OH)3↓
4.盐+盐→新盐+新盐 CuSO4+BaCl2=BaSO4↓+CuCl2
规律:盐1+X1→盐2+X2 即盐和什么类的物质反应还生成盐和那一类的物质。
四、四类能溶于水的物质
溶解性口诀:钾钠铵硝 (K、Na、 NH4、NO3) 全都溶 (如KCl、Na2CO3、 NH4NO3等都溶);
硫钡(硫酸钡,想象三国时的刘备)氯化银不行(其它硫酸盐和盐酸盐都溶),碳(酸的盐)、磷(酸的盐)几乎都不溶;Ba(OH)2可溶碱(联系第一句,碱中只有K、Na、 NH4、Ba的碱才可溶);硝碳盐酸挥发氨(硝酸、碳酸、盐酸和碱--氨水有挥发性)。 即:要记住4种溶的,再记住3个特殊的物质:AgCl、BaSO4、Ba(OH)2就行了。
还可以看出:三大强酸(HCl、H2SO4、HNO3)的盐较易溶; 碳酸盐、磷酸盐和碱大多数不溶。
扩展:酸溶性
多数不溶于水的物质可溶于酸。如碱和碳酸盐的沉淀都能溶于硝酸、盐酸等。
例如:Cu(OH)2+2HCl=CuCl2+2H2O CaCO3+2HNO3=Ca(NO3)2+H2O+CO2↑
但AgCl和BaSO4不仅不溶于水也不溶于酸。因为:AgCl+HNO3≠HCl+AgNO3 BaSO4+2HNO3≠Ba(NO3)2+H2SO4 无气体、水或沉淀生成,不符合复分解反应的条件。
如例6:⑴下列物质中不溶于水的有______既不溶于水也不溶于酸的有___。
①NH4HCO3②KCl③Na2CO3④Mg(NO3)2⑤AgCl⑥BaSO4⑦BaCO3⑧Ag2CO3⑨Ba(OH)2⑩Cu(OH)2
⑵下列各组物质中,都能溶于水的是( )
A、CO2 CaO Na20 Fe2O3
B. CuCl2 BaSO4 Mg(OH)2
C. KOH AgCl CuCO3
D. Ba(OH)2 NH4Cl K2CO3
解答:⑴不溶于水有:5 6 7 8 10 既不溶于水也不溶于酸的:5、6 ⑵ D
五、单质、氧化物、酸、碱、盐五类物质的相互关系
如下图(连线为相互间反应,箭头为转变;粗线为化合反应,粗虚线为分解反应,细线为复分解反应,细虚线为置换反应)。
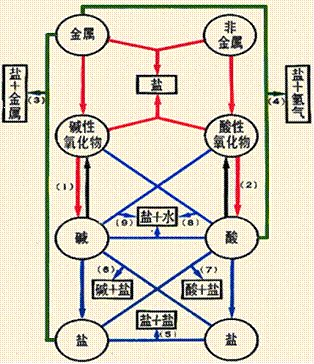
从此图,可以看出物质的性质、相互关系以及制法。如碱和右上、右、右下的物质能发生反应等就是碱的性质。上面已经论述过酸碱盐的性质,就不再赘述了。
(一)、相互关系
纵行:表示了各类物质之间相互转化的关系
如:金属→金属氧化物→碱→盐
Na→Na2O→NaOH→NaCl
说明:金属活动性顺序中Mg前的金属氧化物才能与水反应生成可溶性碱。
再如:碱→金属氧化物
Cu(OH)2 Δ CuO+H2O
横行有:1、金属+非金属→盐 Mg+Cl2 点燃 MgCl2
2、金属氧化物+非金属氧化物→盐 CaO+CO2=CaCO3
3、酸+碱→盐+水 NaOH+HNO3=NaNO3+H2O
4、盐+盐→盐+盐 CuSO4+BaCl2=BaSO4↓+CuCl2
斜方向有:1、金属氧化物+酸→盐+水 CaO+H2SO4 =CaSO4 +H2O
2、非金属氧化物+碱→盐+水②SO2+Ca(OH)2=CaSO3+H2O
3、盐+酸→盐+酸 4、盐+碱→盐+碱
两边:1、金属1+盐1→金属2+盐2 Cu+2AgNO3=Cu(NO3) 2+2Ag
2、金属+酸→盐+氢气:Fe +H2SO4= FeSO4+H2↑
(二)、各类物质的制取
生成该物质的方式有多少,制取的方法就有多少。例如:盐的制备
从反应生成盐我们可以看出盐的制备有:
(1)金属1+盐1→金属2+盐2
(2)金属+酸→盐+氢气
(3)金属+非金属→盐
(4)金属氧化物+非金属氧化物→盐
(5)金属氧化物+酸→盐+水
(6)非金属氧化物+碱→盐+水
(7)酸+碱→盐+水
(8)酸1+盐1→酸2+盐2
(9)碱1+盐1→碱2+盐2
(10)盐1+盐2→盐3+盐4
共10种,被称为十大成盐规律。
如CuSO4的制取有:
①H2SO4+CuO=CuSO4+2H2O②H2SO4+Cu(OH)2=CuSO4+2H2O③H2SO4+CuCO3=CuSO4+2H2O+CO2↑
④Ag2SO4+CuCl2=CuSO4+2AgCl↓⑤Cu+Ag2SO4=CuSO4+2Ag⑥SO3+CuO=CuSO4⑦SO3+Cu(OH)2=CuSO4+H2O
类似的我们还可以推出碱、酸、氧化物的制取等。
12345,上山打老虎,打老虎就容易了。

- 全部评论(0)
