解读铁三角
时间:2014-12-06 19:14 来源:未知 作者:王世坤 点击: 次 所属专题: 铁三角
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
铁是高中化学重要的金属,主要有铁、氧化铁、氢氧化亚铁、氢氧化铁。高考化学中铁的考点主要集中的三价铁和二价铁及其相互转化。
一、铁
铁是银白色光泽的金属,密度大,熔沸点高,延展性,导电导热性较好,能被磁铁吸引。铁在地壳中的含量仅次于氧、硅、铝,排第四。铁是一种副族元素,化合价主要有0价、+2价和+3价,+6价(高铁)不常见。
1.铁与非金属反应
铁可以与许多非金属单质发生反应,与氧化性较强的反应生成三价铁,如氯气,液溴;与氧化性较弱的反应生成二价铁,如硫、碘。
(1)生成三价铁:2Fe+3Cl2 2FeCl3;2Fe+3Br2=2FeBr3;
2FeCl3;2Fe+3Br2=2FeBr3;
(2)生成二价铁:Fe+S FeS;Fe+I2
FeS;Fe+I2 FeI2;
FeI2;
(3)铁在氧气中生成四氧化三铁:3Fe+2O2 Fe3O4,四氧化三铁中含有1/3的二价铁和2/3的三价铁。
Fe3O4,四氧化三铁中含有1/3的二价铁和2/3的三价铁。
2.铁与水反应
铁在高温下可以与水蒸气反应:3Fe+4H2O(g)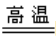 Fe3O4+4H2;
Fe3O4+4H2;
3.铁与酸反应
非氧化性酸反应,主要指稀硫酸或稀盐酸:Fe+2HCl=FeCl2+H2↑;离子反应方程式:Fe+2H+=Fe2++H2↑;
与氧化性酸反应,铁遇冷的浓硫酸会发生钝化反应。
4.铁与某些盐发生置换反应
铁可以与金属活动顺序中排在它后面的金属的盐发生置换反应:Fe+CuSO4=Cu+FeSO4。
二、铁的氧化物
铁的氧化物有氧化亚铁(FeO),氧化铁(Fe2O3)和四氧化三铁(Fe3O4),铁的氧化可以与酸反应,也可以在高温条件下被还原性物质还原。
1.氧化铁与非氧化性酸反应:Fe2O3+6HCl=2FeCl3+3H2O;
2.一氧化碳还原氧化铁:Fe2O3+3CO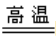 2Fe+3CO2;
2Fe+3CO2;
3.铝热反应:Fe2O3+2Al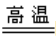 Al2O3+2Fe;
Al2O3+2Fe;
三、铁的氢氧化物
铁的氢氧化物主要有氢氧化铁(Fe(OH)3)和氢氧化亚铁(Fe(OH)2),氢氧化亚铁是白色固体,容易被氧化;氢氧化铁是红褐色固体,经常出现在推断题中。
1.亚铁离子与氢氧根生成氢氧化亚铁:Fe2++2OH-=Fe(OH)2↓;
2.铁离子与氢氧根生成氢氧化铁:Fe3++3OH-=Fe(OH)3↓;
3.氢氧化亚铁与酸发生中和反应:Fe(OH)2+2HCl=FeCl2+2H2O;
4.氢氧化铁与酸发生中和反应:Fe(OH)3+3HCl=FeCl3+3H2O;
5.氢氧化亚铁被氧化:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
6.氢氧化铁加热分解:2Fe(OH)3 Fe2O3+3H2O;
Fe2O3+3H2O;
四、三价铁与二价铁的鉴别
1.两种溶液颜色不同,浅绿色的二价铁溶液,黄色的是三价铁溶液。
2.加入KSCN溶液,显血红色的溶液是三价铁溶液,不显红色,再滴氯水则变红的是二价铁溶液。
3.加入NaOH溶液,生成红褐色沉淀的是三价铁溶液。生成白色沉淀,沉淀马上变为灰绿色,最后变为红褐色,溶液为二价铁溶液。
五、铁三角,铁单质,亚铁离子和铁离子之间的转化
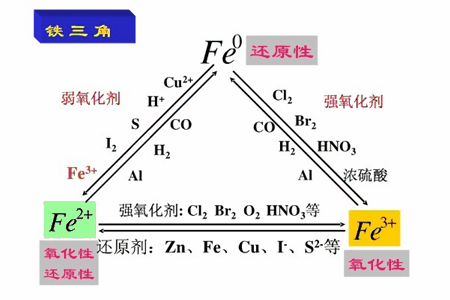
铁单质化合价为0价,只有还原性;亚铁离子为+2价,既有氧化性又有还原性;铁离子为+3价,只有氧化性。
1.铁单质变为亚铁离子,需要与氧化性较弱的物质反应,如稀硫酸、稀盐酸、硫、碘等反应。
2.亚铁离子变为铁单质,需要与还原剂反应,如氢气、一氧化碳、碳、铝、镁、锌等。
FeO+CO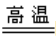 Fe+CO2;FeCl2+Zn=ZnCl2+Fe;
Fe+CO2;FeCl2+Zn=ZnCl2+Fe;
3.铁单质变为铁离子,需要与氧化性较强的物质反应,如氯气、液溴、稀硝酸、浓硝酸等。
4.铁离子变为铁单质,需要与还原性较强的物质反应,如氢气、一氧化碳、碳、铝等。
5.亚铁离子变为铁离子,需要与氧化性强的物质反应,如氯气、溴水、硝酸等。
2FeCl2+Cl2=2FeCl3;
6.铁离子变为亚铁离子,需要与还原性较弱的物质反应,如铜、铁等。
2FeCl3+Fe=3FeCl2;2FeCl3+Cu=2FeCl2+CuCl2。

- 全部评论(0)
