解读铝三角
时间:2014-12-06 19:16 来源:未知 作者:吴琼 点击: 次 所属专题: 铝三角
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
铝是高中化学重要的金属,主要有铝、氧化铝、氢氧化铝。高考化学中铝的考点主要集中的铝及其化合物的两性,即既可以与酸反应,也可以与碱反应。
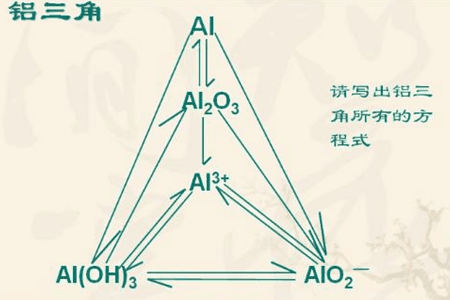
铝三角主要体现了铝及其化合物的两性
一、单质铝(Al)
铝是一种活泼金属,具有金属的共性,能够与非金属、酸、某些盐反应,同时具有自己特有的性质,可以与碱反应。铝极易失去最外层3个电子形成铝离子:Al-3e-=Al3+。
1.铝与非金属反应
铝可以与大多数非金属单质反应,如氧气、氯气、硫、溴等,生成相应的氧化物或盐。
4Al+3O2 2Al2O3;2Al+3S
2Al2O3;2Al+3S Al2S3;2Al+3Cl2
Al2S3;2Al+3Cl2 2AlCl3;
2AlCl3;
2.铝与酸反应
这里所说的酸,主要指稀硫酸和稀盐酸,常温常压下,铝遇浓硫酸或浓硝酸会发生钝化,所以可用铝制容器盛装浓硫酸或浓硝酸。注意钝化也属于化学变化。
2Al+6HCl=2AlCl3+3H2↑;2Al+3H2SO4=Al2(SO4)3+3H2↑;
3.铝与强碱反应
大多数金属不与碱反应,与强碱反应,是铝特有的性质,(锌也可以发生类似的反应,了解即可)
2Al+2NaOH+2H2O==2NaAlO2+3H2↑;对应离子方程式:2Al+2OH-+2H2O==2AlO2-+3H2↑;
该反应的本质是铝首先与水反应,生成氢氧化铝与氢气,2Al+6H2O=2Al(OH)3+3H2↑;然后,氢氧化铝与氢氧化钠反应,2Al(OH)3+2NaOH=2NaAlO2+4H2O。在整个过程中,水是氧化剂,而氢氧化钠不是氧化剂。在解答电子转移和电线桥双线桥法的题目中要注意。
4.铝热反应
铝热反应是指铝在高温条件下还原金属氧化物,置换金属单质的一种反应,不是特指与铝与氧化铁的反应。
2Al+Fe2O3 2Fe+Al2O3,
2Fe+Al2O3,
铝具有较强的还原性,可以还原一些金属氧化物,如氧化钨,二氧化锰等等。
二、氧化铝(Al2O3)
氧化铝熔点较高,硬度较大,可以与酸碱反应。
1.氧化铝与酸反应
Al2O3+6HCl=2AlCl3+3H2O;对应离子方程式:Al2O3+6H+=2Al3++3H2O;
2.氧化铝与碱反应
Al2O3+2NaOH=2NaAlO2+H2O;对应离子方程式:Al2O3+2OH-=2AlO2-+H2O;
3.电解氧化铝生成金属铝
2Al2O3 4Al+3O2↑;加入冰晶石可以降低电解温度。
4Al+3O2↑;加入冰晶石可以降低电解温度。
三、氯化铝(AlCl3)
氯化铝,这里主要说明铝离子的性质,可以与碱反应。
1.氯化铝与弱碱反应
AlCl3+3NH3·H2O=Al(OH)3↓+3NH4Cl;对应离子方程式:Al3++3NH3•H2O=Al(OH)3↓+3NH4+;
2.氯化铝与强碱反应
少量氢氧化钠:AlCl3+3NaOH=Al(OH)3↓+3NaCl;
大量氢氧化钠:AlCl3+4NaOH=NaAlO2+3NaCl+H2O;
依据上述反应方程式,可以得出以下结论,①向氯化铝溶液中逐滴滴加氢氧化钠,首先生成白色沉淀,最后沉淀消失;②向氢氧化钠溶液中逐滴滴加氯化铝溶液,首先没有明显现象,最后生成白色沉淀;③通过两种溶液互相滴加,可以鉴别氯化铝和氢氧化钠。
四、氢氧化铝(Al(OH)3)
氢氧化铝是典型的两性氢氧化物,白色不溶于水的胶状物质,具有吸附作用。可以与强酸或强碱反应。氢氧化铝可以进行酸式水解可碱式水解,H++AlO2-+H2O Al(OH)3
Al(OH)3 Al3++3OH-.
Al3++3OH-.
1.氢氧化铝与强酸反应
Al(OH)3+3HCl=AlCl3+3H2O;对应离子方程式:Al(OH)3+3H+=Al3++3H2O。
2.氢氧化铝与强碱反应
Al(OH)3+NaOH=NaAlO2+2H2O;对应离子方程式:Al(OH)3+OH-=AlO2-+2H2O
3.氢氧化铝加热分解
2Al(OH)3 Al2O3+3H2O
Al2O3+3H2O
五、偏铝酸钠(NaAlO2)
高中化学中,偏铝酸钠只是在体现铝、氧化铝、氢氧化铝的两性的时候出现,这里只说明偏铝酸钠与酸的反应。
1.偏铝酸钠与弱酸反应
NaAlO2+2H2O+CO2=Al(OH)3↓+NaHCO3
2NaAlO2+3H2O+CO2=2Al(OH)3↓+Na2CO3
2.偏铝酸钠与强酸反应
NaAlO2+4HCl=AlCl3+NaCl+2H2O
六、硫酸铝钾(KAl(SO4)2)
KAl(SO4)2•12H2O,十二水合硫酸铝钾,俗名:明矾。因为Al(OH)3具有很强的吸附型,所以明矾可以做净水剂。
KAl(SO4)2=K++Al3++2SO42-,Al3+会水解:Al3++3H2O=Al(OH)3+3H+
附加:氢氧化铝的制法
1.铝离子与弱碱反应
铝离子与强碱反应容易过量,不好控制。
AlCl3+3NH3•H2O=Al(OH)3↓+3NH4Cl;离子方程式:Al3++3NH3•H2O=Al(OH)3↓+3NH4+;
2.偏铝酸根与弱酸反应
偏铝酸根与强酸容易生成铝离子。
NaAlO2+2H2O+CO2=Al(OH)3↓+NaHCO3;离子方程式:AlO2-+2H2O+CO2=Al(OH)3↓+HCO3-,
3.偏离酸根与铝离子反应
偏铝酸根与氯离子发生双水解生成氢氧化铝。
3NaAlO2+AlCl3+6H2O=4Al(OH)3↓+3NaCl;离子方程式:3AlO2-+Al3++6H2O=4Al(OH)3↓;

- 全部评论(0)
惊艳了时光又温柔了岁月(3281467800) 评论 href="/plus/view.php?aid=15215">解读铝三角:不错不错,味道好极了。
