全面解析喷泉实验的原理及其应用
时间:2015-12-20 15:22 来源:未知 作者:彭琳 点击: 次 所属专题: 喷泉实验
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
喷泉实验在高中化学教学中具有相当重要的地位。其实验的要求是:①装置气密性良好;②所用气体能大量溶于所用液体或气体与液体快速反应。实验的基本原理是使烧瓶内外在短时间内产生较大的压强差,利用大气压将烧瓶下面烧杯中的液体压入烧瓶内,在尖嘴导管口形成喷泉。
能进行喷泉实验的物质通常有以下几组:
气体(A) | 液体(B) | 液体(C) | 实验原理 |
NH3 | 水 | 水 | NH3溶解度为1:700 |
HCl | 水 | 水 | HCl溶解度为1:500 |
CO2 | NaOH溶液 | NaOH溶液 | 2NaOH+CO2=Na2CO3+H2O |
SO2 | NaOH溶液 | NaOH溶液 | 2NaOH+SO2=Na2SO3+H2O |
Cl2 | NaOH溶液 | NaOH溶液 | 2NaOH+Cl2=NaClO+NaCl+H2O |
NO2 | 水 | 水 | 3NO2+H2O=2HNO3+NO(不能充满) |
喷泉实验的物理推导原理如下:如右图1所示,在干燥的圆底烧瓶里充满氨气,用带有玻璃管和滴管(滴管里预先吸入水)的塞子塞紧瓶口,立即倒置烧瓶,使玻璃管插入盛有水的烧杯里(水里事先加入少量的酚酞试液),如图安装好装置。打开橡皮管的滴头,使少量水进入烧瓶,氨气溶于水使瓶内压强迅速下降,当瓶内压强下降到一定程度时,外界大气压就将烧杯内的水压入烧瓶,形成喷泉。假设烧瓶的容积为250 mL,玻璃管长35 cm,胶头滴管中可挤出0.5 mL水,那么气体在水中的溶解度多大时才能形成喷泉呢?
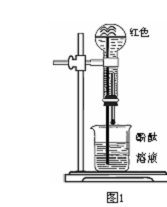
要使水通过玻璃管喷入烧瓶形成喷泉,瓶内外压强差必须超过一个特定的值。设大气压为P0,35 cm水柱产生的压强为P1,形成喷泉时烧瓶内压强为P,要使水柱喷入瓶内,要求P<P0-P1.一个标准大气压相当于10.34 m水柱产生的压强,则P<P0-P1=10.34 m水柱-0.35 m水柱=9.99 m水柱。根据波意尔定律,当压强由10.34 m水柱变为9.99 m水柱时,气体的体积由250 mL变为V,![]() =
=![]() ,V=241.5 mL,即烧瓶内气体体积至少减少250 mL-241.5 mL=8.5 mL.故当滴管内0.5 mL水
,V=241.5 mL,即烧瓶内气体体积至少减少250 mL-241.5 mL=8.5 mL.故当滴管内0.5 mL水
挤入烧瓶后如能溶解8.5 mL 1标准大气压的气体,即1 mL水溶解多于17 mL气体时,就能形成喷泉。NH3、HBr、HCl、HI、SO2、NO2等气体的溶解度均大于17,在水中都能形成喷泉。CO2、H2S、Cl2等气体在水中不能形成喷泉,但在NaOH溶液中可以形成喷泉。 根据其原理进行拓展还可以探讨喷泉实验的多种应用。
一、根据实验装置进行的条件拓展
例1、制取氨气并完成喷泉实验(图2中夹持装置均已略去)。
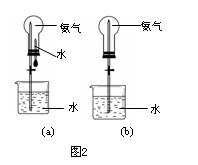
(1) 写出实验室制取氨气的化学方程式: _________。
(2) 收集氨气应使用_____法,要得到干燥的氨气可选用_____做干燥剂。
(3) 用图(a)所示的装置进行喷泉实验,上部烧瓶已装满干燥氨气,引发上述喷泉的操作是________________。该实验的原理是________________________。
(4)如果只提供如图(b)的装置,请说明引发喷泉的方法。
答:______________________________________________。
解析:因做喷泉实验的两个关键是:①使气体与溶剂接触。 ②是使烧瓶内气体压强迅速减小造成内外压差比较大即可发生喷泉现象。 根据这两点可回答第③④两问的问题。
答案: (1) 2NH4Cl+Ca(OH)2![]() 2NH3↑+CaCl2+2H2O
2NH3↑+CaCl2+2H2O
(2) 向下排空气 碱石灰
(3) 打开止水夹,挤出胶头滴管中的水。氨气极易溶解于水,致使烧瓶内气体压强迅速减小。
(4) 方法一、打开夹子,用手(或热毛巾等)将烧瓶捂热,氨气受热膨胀,赶出玻璃导管内的空气,氨气与水接触,即发生喷泉;方法二、烧瓶上覆盖冷毛巾或淋洒冷水,使烧瓶内温度降低,压强减小,从而引发喷泉;方法三、在烧瓶上涂抹无水乙醇,由于乙醇挥发带走热量使烧瓶内温度降低,压强减小,引发喷泉。
二、根据实验中出现的现象进行的问题拓展
例2、某同学用HCl气体做喷泉实验时,喷入烧瓶内的水不足烧瓶容积的1/3,其原因不可能是( )。
(A)烧瓶潮湿 (B)装置气密性不好 (C)水里没有加石蕊试液 (D)烧瓶内未集满HCl
解析:喷泉实验失败的原因很多,要弄清本质进行大胆假设。很明显(A)(B)(D)都能使喷入烧瓶内的水不足烧瓶容积的1/3,所以答案为(C)。
三、根据实验中发生的现象进行的操作拓展
例3、如图3所示,甲学生在烧瓶中充满O2,并在反匙燃烧匙中加入一种白色固体物质,欲做O2的喷泉实验。实验开始,用凸透镜将日光聚焦于反匙燃烧匙中的固体,燃烧匙内出现一阵火光和白烟。等一会儿,打开橡皮管上的止水夹。看到有美丽的喷泉发生。请问他在反匙燃烧匙中加入了什么物质?
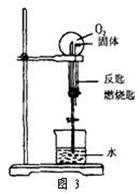
解析:综合分析上述实验中产生的现象,结合喷泉实验的原理,我们会很容易想到反匙燃烧匙中加入的物质是白磷。白磷与烧瓶内的O2反应生成P2O5固体,使烧瓶内压强减小。打开止水夹后烧杯中的水被压入烧瓶内形成喷泉。
四、根据实验中的生成物进行的原理拓展
例4、如图4装置,实验前a、b、c活塞均关闭。若要在该装置中产生喷烟现象,该怎样操作?若想在该装置中产生双喷泉现象,该怎样操作?
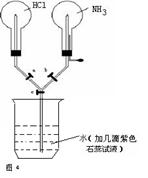
解析:挤压胶头滴管,滴管中的水溶解右瓶中的部分NH3使瓶内压强减小。打开活塞a、b,左瓶中的HCl进入右瓶生成NH4Cl固体而产生喷烟现象。若此时打开活塞c,则烧杯内的水会压向左右两个烧瓶,在左瓶中产生红色喷泉,在右瓶中产生蓝色喷泉。
五、根据实验中的反应物进行的操作拓展
例5、把充满乙烯的圆底烧瓶用带有尖嘴导管的橡皮塞塞紧,按图5安装好仪器。怎样操作会引发喷泉?
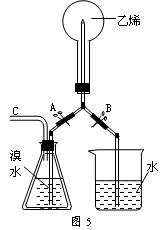
解析:松开弹簧夹A,通过导管C向盛溴水的锥形瓶中鼓入空气,使约10 mL溴水压入烧瓶,再把弹簧夹A夹紧。振荡烧瓶,溴水很快褪色,有油状物生成,烧瓶内形成负压。松开弹簧夹A,溴水自动喷入。喷入约10 mL溴水后,再把弹簧夹A夹紧,振荡烧瓶,溴水又很快褪色。如此重复操作几次。当喷入的溴水颜色不能完全褪尽时,说明烧瓶中的气体已经完全反应。松开弹簧夹B,让蒸馏水喷入烧瓶也可形成喷泉。只要反应完全,液体几乎可充满整个烧瓶。
六、根据生成物浓度进行的计算拓展
例6、标准状况下两个等体积的干燥烧瓶中分别充满①NH3②NO2,进行喷泉实验,经充分反应后烧瓶内溶液的物质的量浓度为( ) 。
(A)①<②(B)①>②(C)①=②(D)无法确定
解析:①设烧瓶的体积为V L,则充满NH3后气体的物质的量为![]() mol。发生喷泉现象后,烧瓶将充满溶有NH3的溶液,即溶液的体积为VL,所以烧瓶内溶液的物质的量浓度为
mol。发生喷泉现象后,烧瓶将充满溶有NH3的溶液,即溶液的体积为VL,所以烧瓶内溶液的物质的量浓度为![]() mol/L。
mol/L。
②设烧瓶的体积为VL,则充满NO2后气体的物质的量为![]() mol。发生如下反应:3NO2+2H2O=2HNO3+NO,反应后生成HNO3的物质的量为
mol。发生如下反应:3NO2+2H2O=2HNO3+NO,反应后生成HNO3的物质的量为![]()
![]()
![]() mol。由于剩余
mol。由于剩余![]() V L NO气体,所以烧瓶中溶液的体积为
V L NO气体,所以烧瓶中溶液的体积为![]() V L,因此烧瓶内溶液的物质的量浓度也为
V L,因此烧瓶内溶液的物质的量浓度也为![]() mol/L。所以答案选(C)。
mol/L。所以答案选(C)。
七、根据实验原理进行反向思维拓展
例7、①如图6装置,在锥形瓶中加入足量的下列物质,能产生喷泉现象的是()
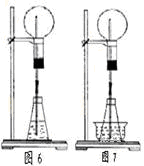
(A)碳酸钠和稀盐酸 (B)氢氧化钠和稀盐酸 (C)铜和稀硫酸 (D)硫酸铜和氢氧化钠溶液
解析:碳酸钠和盐酸反应能产生大量的CO2气体使锥形瓶内的压强增大,从而将反应混合物压入烧瓶。也能形成喷泉。所以答案选(A)。
②如图7装置,在锥形瓶外放一个水槽,瓶中加入酒精,水槽中加入冰水后,再加入足量的下列物质,产生了喷泉,问水槽中加入的物质可以是( )。
(A)浓硫酸(B)食盐(C)硝酸钾(D)硫酸铜
解析:浓硫酸溶于水放热,可使锥形瓶内的酒精部分气化而使锥形瓶内压强增大,将酒精压入烧瓶形成喷泉。答案为(A)。
八、根据喷泉原理进行的迁移拓展
例8、如图8所示,锥形瓶内盛有气体X,滴管内盛有液体Y。若挤压滴管胶头,使液体Y滴入锥形瓶中,振荡,过一会儿,可见小气球a鼓胀起来。气体X和液体Y不可能是( ) 。
(A)NH3 H2O
(B)SO2 NaOH溶液
(C)CO2 6 mol/L H2SO4溶液
(D)HCl 6 mol/L Na2SO4溶液
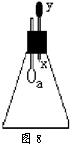
解析:当滴入的液体Y将锥形瓶中的气体X溶解或发生反应后,使锥形瓶中的压强减小,大气压通过导管将空气压入小气球a使它鼓胀起来。因此,不符合条件的只有(C)。这个实验虽然没有产生喷泉现象,但它的原理跟喷泉实验原理是相同的。
课本上一个简单的演示实验,可以演变出这么多的拓展问题,说明了化学学科的博大精深,同时也说明了发散思维的重要性。只要我们勤于思考,善于总结,就能做到举一反三。

- 全部评论(0)
