热点物质:硫代硫酸钠知识点探析
时间:2020-03-05 18:57 来源: 作者:雷海青 点击: 次 所属专题: 热点物质 硫代硫酸钠
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
硫代硫酸钠晶体(Na2S2O3·5H2O)为无色透明的晶体,易溶于水,俗名为海波、大苏打。在化学教科书中虽然没有涉及到硫代硫酸钠的内容,但在高考中却多次出现。现把硫代硫酸钠的一些重要知识点归纳如下。
知识点1 硫代硫酸钠的结构
硫代硫酸钠中的S2O32-可看成是SO42-中的一个非羟氧原子被硫原子所代替,所以S2O32-与SO42-相似,具有四面体结构。S2O32-的结构式可表示为:
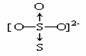
在S2O32-中的S原子的平均化合价为+2价,但两个S原子的化合价并不相同,中心原子S为+6价,另一个S原子为-2价。
例1.将放射性的同位素35S与非放射性的Na2SO3溶液一起加热煮沸可得Na2S2O3,若将所得Na2S2O3酸化,又可得到放射性的35S沉淀和逸出无放射性的气体SO2,这表明( )
A.两种硫原子之间发生交挽作用
B.Na2S2O3中的两个硫原子不等价
C.Na2S2O3中的两个硫原子等价
D.在合成Na2S2O3时,放射性硫作还原剂
解析:35S与非放射性的Na2SO3反应得到的Na2S2O3酸化时,生成的放射性的35S只在沉淀中,说明它们没有发生交挽作用。据S2O32-+2H+==SO2↑+35S↓+H2O,可看出1molS2O32-(S的平均化合价为+2价)与2molH+反应转移的电子数为2mol。结合S2O32-中两个硫原子的化合价,应有35S → 35S,S → SO2,这样可确定Na2S2O3中35S为-2价,非放射性S为+6价,因此在合成Na2S2O3时,放射性硫作氧化剂。故答案为B项。
知识点2 硫代硫酸钠的不稳定性
硫代硫酸钠在酸性溶液中会迅速分解,生成硫和二氧化硫气体,方程式为:
Na2S2O3+H2SO4==H2S2O3+Na2SO4
H2S2O3==SO2↑+S↓+H2O
例2.(1995年全国高考化学题)在pH=1的溶液中,可以大量共存的离子组是( )
A.Na+、K+、S2-、Cl- B.Al3+、Mg2+、SO42-、 Cl-
C.K+、 Na+、AlO2-、NO3- D.K+、 Na+、 SO42-、S2O32-
解析:pH=1的溶液,即为酸性溶液,因此,在每组离子中都应加上H+。A项因S2-+H+==H2S↑而不能共存;C项因AlO2-+4H+ ==Al3++2H2O而不能共存;D项因2H++S2O32-==SO2↑+S↓+H2O而不能共存。故答案为B项。
知识点3 硫代硫酸钠的还原性
由于硫代硫酸钠中有-2价的S,故其具有还原性。在纺织工业上常用作棉织物漂白后的脱氯剂,方程式为:
Na2S2O3+4Cl2+5H2O==2NaCl+2H2SO4+6HCl
在分析化学中常用于定量滴定I2,方程式为:
2Na2S2O3+I2==Na2S4O6+2NaI
例3.(2000年全国高考化学题)硫代硫酸钠可作为脱氯剂,已知25.0mL 0.100mol·L-1 Na2S2O3溶液恰好把224mL(标准状况下)Cl2完全转化为Cl-离子,则S2O32-将转化成()
A.S2- B.S C.SO32- D.SO42-
解析:参加反应的Cl2为0.224L÷22.4L·mol-1=0.01mol,Na2S2O3为25.0×10-3L
×0.100mol·L-1 =0.0025mol。设S2O32-转化成的物质中S的化合价为x,根据氧化还原反应电子守恒原理,有0.01×[0-(-1)]×2=0.0025×[x-(+2)]×2,x=6,即反应后的物质中S的化合价为+6价,可知是SO42-。故答案为D项。
例4.(2004年全国高考理综题)抗击“非典”期间,过氧乙酸(![]() )是广为使用的消毒剂。它可由H2O2和冰醋酸反应制取,所以在过氧乙酸中常含有残留的H2O2。测定产品中过氧乙酸浓度c0,涉及下列反应:
)是广为使用的消毒剂。它可由H2O2和冰醋酸反应制取,所以在过氧乙酸中常含有残留的H2O2。测定产品中过氧乙酸浓度c0,涉及下列反应:
①□MnO4-+□H2O2+□H+ == □Mn2++□O2↑+□H2O
② H2O2+2I-+2H+== I2+2H2O
③![]() + 2I-+2H+ == CH3COOH+I2+H2O
+ 2I-+2H+ == CH3COOH+I2+H2O
②I2+2S2O32- == S4O62-+2I-
请回答以下问题:
(l)配平反应①的离子方程式(配平系数填人以下方框内):
□MnO4-+□H2O2+□H+ == □Mn2++□O2↑+□H2O
(2)用Na2S2O3标准溶液滴定I2时(反应④)选用的指示剂是_________。
(3)取b0 mL待测液,用硫酸使溶液酸化,再用浓度为a1mol·![]() 的KMnO4标准溶液滴定其中的H2O2,耗用的KMnO4体积为b1 mL(反应①,滴定过程中KMnO4不与过氧乙酸反应)。
的KMnO4标准溶液滴定其中的H2O2,耗用的KMnO4体积为b1 mL(反应①,滴定过程中KMnO4不与过氧乙酸反应)。
另取b0 mL待测液,加入过量的KI,再用硫酸使溶液酸化,此时过氧乙酸和残留的H2O2都能跟 KI反应生成 I2(反应②和③)。再用浓度为a2 mol·![]() 的Na2S2O3标准溶液滴定生成的I2,耗用Na2S2O3溶液体积为b2 mL。请根据上述实验数据计算过氧乙酸的浓度(用含a1、a2、b0、b1、b2的代数式表示)c0= ___。
的Na2S2O3标准溶液滴定生成的I2,耗用Na2S2O3溶液体积为b2 mL。请根据上述实验数据计算过氧乙酸的浓度(用含a1、a2、b0、b1、b2的代数式表示)c0= ___。
(4)为计算待测液中过氧乙酸的浓度c0,加入的KI的质量已过量但没有准确称量,是否影响测定结果 ____(填“是”或“否”)。
解析:
(l)根据氧化还原反应方程式配平方法,配平的方程式为:
2MnO4-+5H2O2+6H+ == 2Mn2++5O2↑+8H2O
(2)I2与Na2S2O3的反应十分灵敏而且进行得很彻底,所以常用淀粉作为指示剂,通过该反应测定溶液中I2的含量。
(3)据关系式2MnO4-—5H2O2,可计算出待测液中H2O2为5a1b110-3/2mol;由关系式H2O2—I2,可知待测液中H2O2与KI反应生成的I2为5a1b110-3/2mol;再据关系式I2—2Na2S2O3,可计算出待测液中H2O2、CH3COOOH与KI反应总共生成的I2为a2b210-3/2mol;又据关系式CH3COOOH—I2,可知待测液中的CH3COOOH为(a2b210-3-5a1b110-3)/2mol,则CH3COOOH的浓度c0=(a2b2-5a1b1)/
2b0mol·![]() 。
。
(4)因I-仅与H2O2和CH3COOOH反应,不与Na2S2O3反应,所以只要保证加入的KI的质量确已过量(不必精确称量)就不会影响测定结果。
知识点4 硫代硫酸钠的制备
实验室中常用硫磺和亚硫酸钠共煮制备硫代硫酸钠。方程式为:Na2SO3+S==Na2S2O3,工业上则将二氧化硫气体通入一定浓度的硫化钠和碳酸钠的混合溶液中制备硫代硫酸钠。方程式为:
2Na2S+Na2CO3+4SO2 == 3Na2S2O3+CO2
|
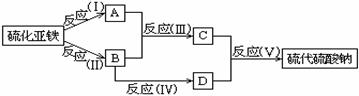
例5.(1993年全国高考化学题)已知硫粉跟亚硫酸钠溶液共热可制得硫代硫酸钠。现以硫化亚铁为主要原料,按下图制取硫代硫酸钠。图中的A、B、C和D是硫单质或硫的化合物,其它不含硫的反应产物已被略去,各步反应可以添加必要的试剂。请填写下列空白:
(1) 反应(Ⅰ)的化学方程式是 ;
(2) 物质B的分子式是 ;
(3) 物质D的分子式 。 .
解析:由图示,C、D必为S和Na2SO3,而C由A、B反应制得,又知A、B、C均为含硫物质,故此反应必定为高低硫元素和低价硫元素之间发生的归中反应。由此可联想到H2S和SO2反应能得到S,这样可确定C为S,D为Na2SO3,进而可确定B为SO2,A为H2S。制取H2S的化学方程式为:FeS+2HCl=FeCl2+H2S↑。

- 全部评论(0)