离子晶体溶解度规律浅析
时间:2016-03-17 18:00 来源:未知 作者:陈阳 点击: 次 所属专题: 离子晶体 溶解性
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
物质的溶解度是一个涉及到晶格能、水合能、键 能等许多因素的复杂问题。一般说来,凡是以离子 键相结合的无机化合物是可溶于水的。因为水的介 电常数很大(约等于80),阴阳离子间的吸引力在水中可以减少80倍,很容易受热运动而互相分离溶 解。但是,在离子间有极化作用存在,则离子键就逐 渐向共价键过渡,而共价型无机物在水中是难溶的, 因为介电常数大对共价键结合力没有影响,因此可 以说随着无机物中离子间相互作用的增强,其溶解 度要相应降低。
1、离子极化作用小的离子晶体
离子极化作用小的离子晶体在水中溶解度的相 对大小,大致有如下规律:小的阳离子与大的阴离子 (小一大)、大的阳离子与小的阴离子(大一小)组成 的离子晶体,溶解度相对较大;小的阳离子与小的阴 离子(小一小)、大的阳离子与大的阴离子(大一大) 组成的离子晶体,溶解度相对较小。根据离子半径 的相对大小,可定性判断同系列离子晶体溶解度的 相对大小。如表1所列。
表1晶体的溶解度相对大小 与组分离子半径相对大小的关系
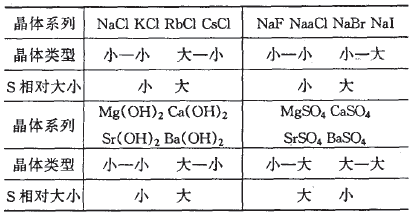
可从离子晶体在水溶液中的溶解过程分析上述规律。
对离子型的化合物的溶解过程,可建如下玻 恩一哈伯循环:

拆散晶体成为组分离子和离子进入溶液成为水合离子这两个过程,均会发生焓变和熵变。溶解总过程的自由能变化:ΔG=ΔH-TΔS显然298K 时,ΔG负值越大,则离子化合物的溶解度越大;反之,如为较大的正值,则盐类为难溶或不溶。总之, 焓减(ΔH<0)、熵增(ΔS>0)有利于溶解。
溶解总过程焓变、熵变的大小均决定于离子电 荷和半径。拆散晶格须克服晶格能,其大小正比于 Z+Z-/(r+ + r-);离子水合能的确大小正比于 Z2+/r+和Z2-/r-。晶格能大对溶解不利;水合能大 (放出能量多)对溶解有利。因此在同系列晶体中, 一般离子半径反向影响晶格能和离子水合能的大 小,而且影响程度是不同的。可以看出,由“小一大” 或“大一小”阳、阴离子组成的晶体与“小一小”或“大 —大”阳、阴离子组成的晶体相比较,对于前者(小一 大或大一小),r影响的结果是晶格能较小而离子总 的水合能较大,因而溶解度相对较大;后者溶解度相对较小。因此可预测同系列离子晶体中首尾两头的 晶体溶解度的相对大小,如前所举四系列晶体。但 是系列中间的晶体溶解度相对大小不好预测。
我国一些化学工作者,就离子半径对晶格能、离 子水合能、溶解摘变的影响(综合为对离子晶体溶解度的影响),进行了定量研究,提出了无机盐溶解度判据——0.75规则。
此规则指出,同一系列离子晶 体溶解度相对大小有如下规律:
r+/r-≈0.75时,溶解度最小。
r + /r-< 0.75时,溶解度随r+ /r-增大而减小。
r+/r- >0.75时,溶解度随r+/r-增大而增大。
从表2所列离子晶体20℃的溶解度可看出此规律。
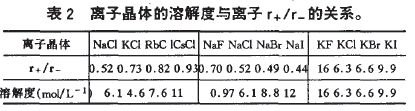
表2离子晶体的溶解度与离子r+/r-的关系。
除了不同碱金属与同一卤素组成的卤化物和同 一碱金属与不同卤素组成的卤化物有此规律外,其 它MX类型离子晶体溶解度的相对大小也有类似 规律。
上述规律只适用于离子极化作用很小的离子晶体。
2、离子极化作用强的离子晶体
对于离子极化作用强的离子晶体,其溶解度相对大小的规律是:离子极化作用越强,在水中溶解度 越小。因为离子极化作用越强,键的离子成分越少, 共价成分越多。极化作用的强弱决定于离子电荷、 离子半径及离子的电子构型。晶体中阴、阳离子电 荷数越高、阳离子半径越小、阴离子半径越大极化作 用越强。尤其非惰性气构型阳离子与大的阴离子组 成的晶体极化作用是较强的。例如:AgF、 AgCl、 AgBr

极化作用增强
共价成分增多溶解性降低
3、溶解性规律
如以Z2/r表征阳离子对阴离子的极化力,则有如下溶解性规律:
(1) Z2/r<2:阴离子的极化力很弱,这类金属所 组成的化合物大都溶于水中,如碱金属的化合物。 但当阴离子为复杂离子(如BiI4-、SbI4-、MnO4 和 SnCl62-等)时,由于其中变革形性很小,也可使Rb+、Cs+沉淀。
(2) 2<Z2/r<7:阳离子的极化力较弱,即使与 易变形的阴离子所组成的化合物,其溶解度也较小, 如碱土金属的碳酸盐、草酸盐、氢氧化物等。
(3) Z2/r>7:阳离子极化力很强,这类金属离子 (如Be2+、Al3+、Sc3+、)的氢氧化整为零物和盐都难 溶于水。

- 全部评论(0)
