教材分析(物质结构与性质):金属晶体与离子晶体
时间:2023-09-04 16:41 来源:未知 作者:张德金 点击: 次 所属专题: 金属晶体 离子晶体
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、金属晶体与金属键
1、固态的金属都是晶体,称为金属晶体。
金属晶体中,金属原子以紧挨的形式层层堆积。

不同的金属堆积方式有所不同,有简单立方、体心立方(钾型)、面心立方(铜型)、六方(镁型)等堆积方式。
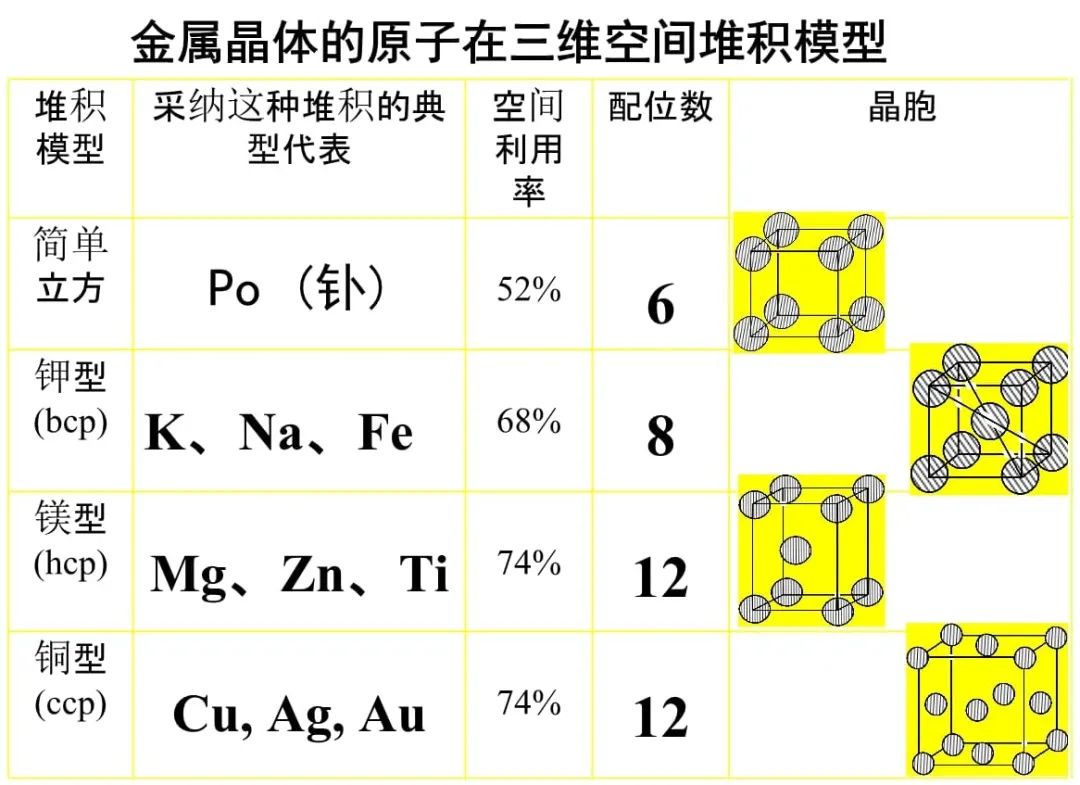
金属晶体的配位数是指每个金属原子周围离它最近的金属原子的数目。
2、金属键
在金属晶体中,原子之间以金属键相互结合。
金属键不像一个阳离子与一个阴离子之间的离子键,也不像一个原子和另一个原子之间的共价键。
解释金属键本质的最简单理论是“电子气理论”。该理论把所有从金属原子上面脱落下来的价电子描绘成遍布整个晶体的电子气,电子气被所有原子共用,把所有原子维系在一起。
就如同小米粥中的小米粒与米糊之间的关系。
金属键没有方向性。

电子气理论能很好的解释金属晶体的导电性、导热性、各向同性、延展性等。
(1)导电性:通电时,电子气会在电场中定向移动,形成电流。
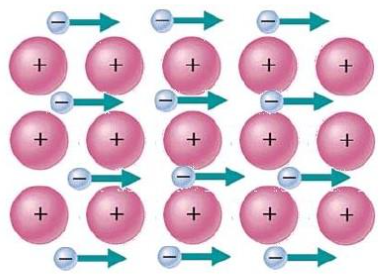
(2)导热性:加热时,电子气中的所有自由电子在热的作用上运动速度加快,与周围金属原子频繁碰撞,导致金属原子的振动剧烈,温度升高,热量传递较快。
而温度升高,金属原子的振动加剧,对电子气的定向移动不利,电导率反而下降。
(3)各向同性:金属晶体从不同角度上,都是层层排列,排列方式也是相似的,所以性质的表现也是相似的。
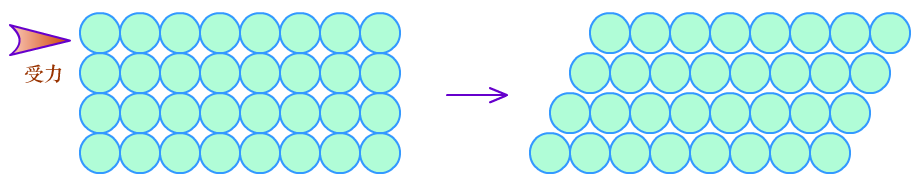
(4)延展性:
由于金属原子层层排列,电子气又起了润滑作用,当每层金属原子受到力量时,容易发生相对滑动,使金属晶体有较好的延展性。
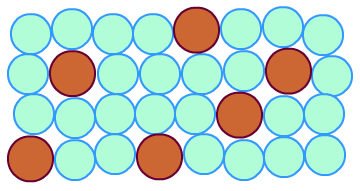
当金属变为合金时,金属原子不容易发生相对滑动,金属的延展性变差,硬度变大。
二、离子晶体
1、离子晶体
由阳离子和阴离子相互作用而形成的晶体。
(1)常见的离子化合物主要有金属阳离子或铵根阳离子与阴离子组成。
如,MgO、Mg3N2、Ca3P、NaH、CaC2,Na2S、KI、NaBr、CuCl2、CaF2,NH4Cl,KOH,CaCO3、BaSO4、KNO3,CuSO4·5H2O等。
(2)离子晶体晶胞的结构受三种因素影响
①几何因素:受阳离子与阴离子的半径比例影响。
在晶体中,阳离子与阴离子交替相互紧挨,半径比例不同,晶胞的结构不同。
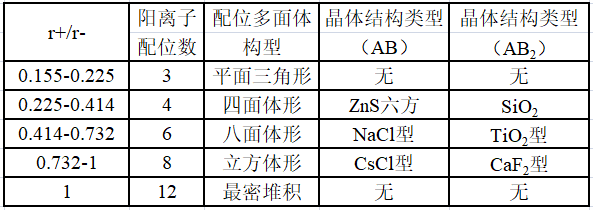
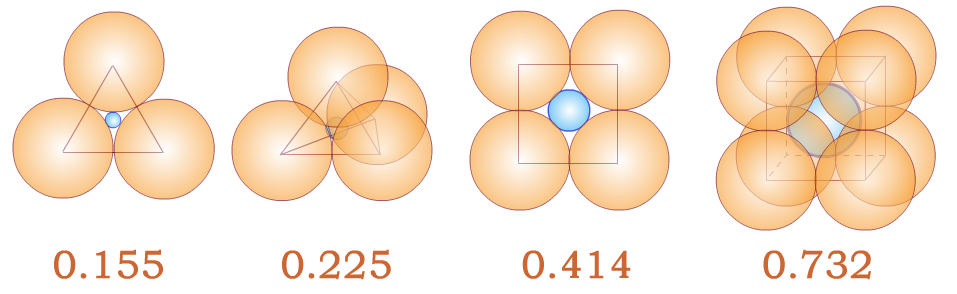
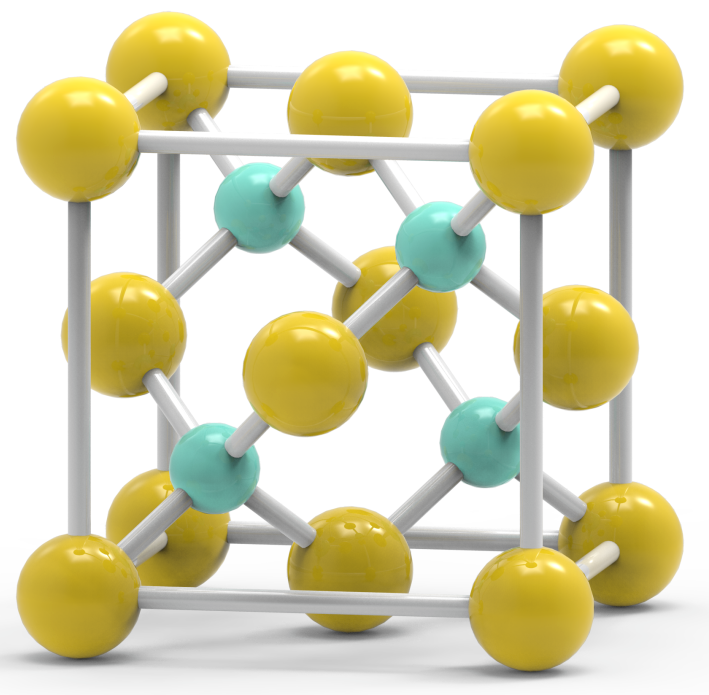
下面分别是NaCl、CsCl、ZnS的晶胞结构:


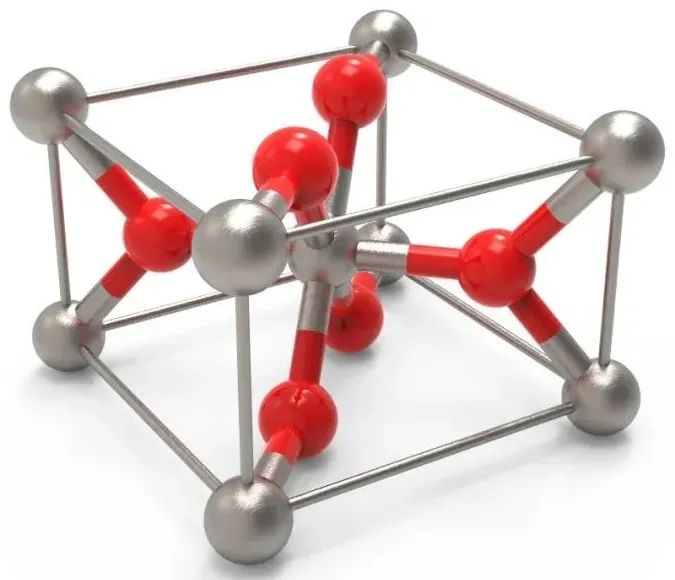
②电荷因素:受阳离子与阴离子的电荷比影响,也就是阳离子与阴离子的个数比影响。
下面分别是CaF2、TiO2的晶胞结构,注意CaF2与CsCl的对比:

③键性因素:受离子键的纯粹程度影响。
如果离子键的纯粹程度降低,离子键会慢慢过渡到共价键,离子晶体也会慢慢过渡到共价晶体。
(3)空间占用率和密度计算
以NaCl为例(Na+半径为102pm,Cl-半径为181pm)
空间占用率计算
=[4л/3(1023+1813)╳1/2]/(102+181)3
=64.6%
密度计算
=[(58.5/2)/6.02╳1023]g/[(102+181)╳10-10cm]3
=2.14 g/cm3
(NaCl的实际密度为2.165 g/cm3)
2、晶格能
晶格能是指在标准状况下,使1mol离子晶体变成气态正离子和气态负离子时所吸收的能量。
MaXb(s) →aMb+(g)+bXa-(g)ΔH(>0)
影响晶格能大小的因素主要是离子半径、离子电荷以及离子的电子层构型等。
例如,晶格能比较:NaF>NaCl>NaBr>NaI,对应NaF的熔点也大于NaCl的熔点。
晶格能比较:MgO>NaF,对应MgO的熔点也大于NaF的熔点。
晶格能比较:Na2S>Cu2S,Cu+和Na+半径相近、离子电荷相同,但Cu+是18电子构型,Na+是8电子构型,Cu+的极化作用大于Na+,所以共价键成分更多,晶格能更小,熔沸点更低。
三、过渡晶体与混合型晶体
1、过渡晶体
除了四类典型晶体(分子晶体、共价晶体、金属晶体、离子晶体)之外,大多数晶体是它们之间的过渡晶体。
以第三周期元素的氧化物为例,化学键中离子键成分的百分数如下表
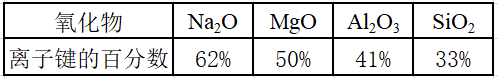
以上四种氧化物的晶体中的化学键都不是纯粹的离子键,也不是纯粹的共价键,这些晶体既不是纯粹的离子晶体,也不是纯粹的共价晶体,是离子晶体和共价晶体之间的过渡晶体。
而P2O5、SO3、Cl2O7都是分子晶体,它们的化学键中的离子键成分的百分数更小,共价键不再贯穿整个晶体。
2、混合型晶体
晶体内可能同时存在着若干种不同的作用力,具有若干种晶体的结构和性质,这类晶体称为混合型晶体。
石墨晶体就是一种混合型晶体。
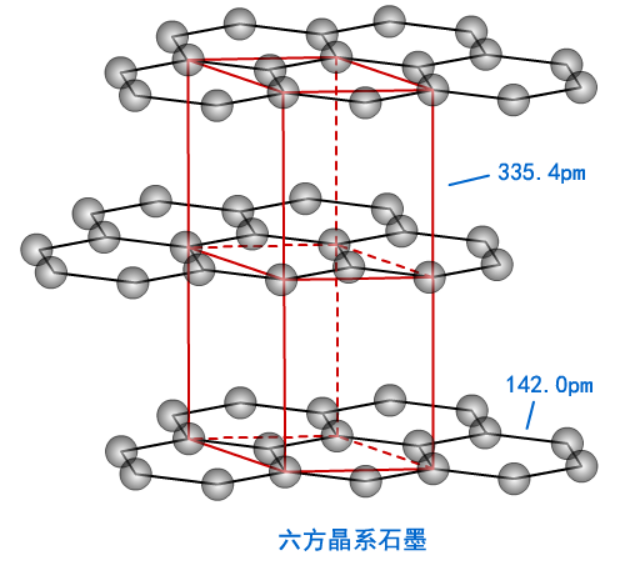
它是层状结构。层内的碳原子呈正六边形分布,核间距为142.0pm,原子之间全部以共价键相连。所以石墨的熔点很高。
层间距离为335.4pm,层与层之间的作用力为范德华力。所以石墨硬度很小。
碳原子采用sp2杂化,配位数为3,有一个未参与杂化的2p电子。在每一层二维结构中,此电子的原子轨道垂直于碳原子平面,所有p轨道相互平行且相互重叠,使p轨道中的电子可以在整个碳原子平面中运动。所以石墨有导电性。

二维石墨平面

- 全部评论(0)
