对化学平衡常数单位含义的探讨
时间:2016-03-30 20:42 来源:未知 作者:刘明 点击: 次 所属专题: 化学平衡常数
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
化学平衡常数是高考考试大纲新增内容。从近几年的高考中发现,化学平衡常数早已成为高考命题的热点内容, 而化学平衡常数有无单位在高考试题中一直未引起学者们 取视。下面以近几年高考试题为例,将化学平衡常数在高考中有无单位进行分析。
在中学教材中,化学平衡常数是不带单位的。在2012 年海南卷中也没带单位,但在2014年的全国卷中却带了单位,到底带不带单位成了学生学习中的疑点,要解决这个问题,就需搞淸楚化学平衡常数单位的含义。
化学平衡常数用符号K表示,它有两种:标准平衡常数和非标准平衡常数。根据平衡时生成物对反应物的压力商或浓度商表示的平衡常数是经验平衡常数(Kp或Kc),或称为非标准平衡常数;用标准热力学函数算得的平衡常数是标准平衡常数,记作K,又称之为热力学平衡常数。本文从质量作用定律和热力学基本方程式两个方面阐明了化学平衡常 数有无单位。
1、由质量作用定律导出的化学平衡常数
在温度T时,对于任意的气相可逆反应(均视为理想气体),aA(g)+bB(g) gG(g)+dD(g)达平衡时,由质量作用定律推得其反应的化学平衡常数可表示为下式:
gG(g)+dD(g)达平衡时,由质量作用定律推得其反应的化学平衡常数可表示为下式:
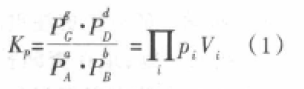
其中Vi为反应方程式计量系数(对生成物Vi取正值,对反应物Vi取负值);Pi反应体系中某一气体组分的平衡分压(绝对压力),单位以前曾采用atm、mmHg、1N/m2。现在采用SI制bar或Pa(KPa)。从式(1)可以看出,由于反应前后气体物质的量变化ΔV=(g+d)-(a+b),一般不等于零,所以理想气体的压力是有单位的,故得到的化学平衡常数(Kp)也是有单位的,其单位为[压力单位]ΔV,它可以看作是以绝对压力表示的化学平衡常数(也称经验平衡常数或非标准平衡常数)。
2、热力学基本方程式导出的化学平衡常数
某一反应在温度T时,任意状态的Gibbs变,ΔGT和标淮状态的Gibks函数变之间的关系,可用等温方程式表述, 如,对于任意的气相可逆反应(均视为理想气体), aA(g)+bB(g) gG(g)+dD(g),等温式可写作
gG(g)+dD(g),等温式可写作
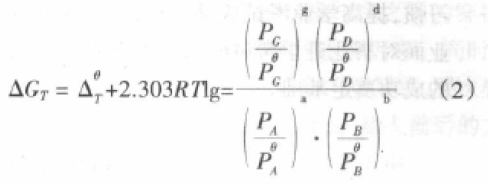
其中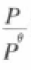 叫作相对压力,它是无单位的。过去是将标 态压力定为1atm,现在将标态压力定为Bar,(1Bar=1×105Pa=100KPa),即
叫作相对压力,它是无单位的。过去是将标 态压力定为1atm,现在将标态压力定为Bar,(1Bar=1×105Pa=100KPa),即 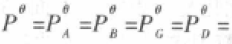 1 Bar,理想气体压力P也以Bar计,那么相对压力在数值上等于理想
1 Bar,理想气体压力P也以Bar计,那么相对压力在数值上等于理想
气体的压力P,而其物理意义就是相对于标准状态的压力(若理想气体的压力P单位不为Bar或atm, |而为Pa或mmHg ,则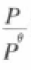 式中压力比值与理想气体的压力是不相等的)。但是它并不能真正代表理想气 体的压力(因为压力是有单位的,而相对压力是无单位的)。若体系处于平衡状态,则反应的ΔGT=0。
式中压力比值与理想气体的压力是不相等的)。但是它并不能真正代表理想气 体的压力(因为压力是有单位的,而相对压力是无单位的)。若体系处于平衡状态,则反应的ΔGT=0。
(2)式体系中各气态 物质的分压均成为平衡时的分压,此时生成物相对压力次方 的乘积比上反应物相对压力次方的乘积就为一常数,此常数 就是化学平衡常数,表示为:
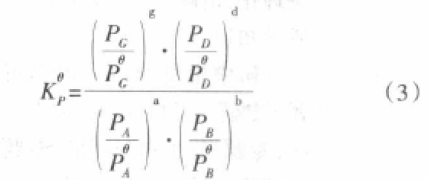
则(2)式就变为: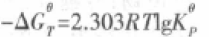 或
或
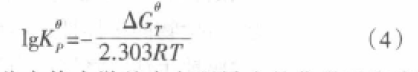
因此由热力学基本方程导出的化学平衡常数,是相比于标准态的“相对值”,是一个无单位的相对值,我们可以把它理解为以相对压力表示的化学平衡常数(我们称之为标准平衡常数)。
从上面讨论我们可以看出:对于反应物计量系数之和等于生成物计量系数之和的反应,其经验平衡常数是无量纲的纯数,与压力、浓度所用的单位无关,而且也等于标准平衡常数之值。对于反应物计量系数之和不等于生成物计最系数之 和的反位,则其经验平衡常数是有量纲的量,其数值就与压 力、浓度所用的单位有关。只有当压力、浓度的单位与热力学数据表中对应标准态的单位相同时,所计箅的经验平衡常数数值才能与标准平衡常数数值相同。从本质上讲,它确是没有量纲的量,而且二者是统一的。中学教材中涉及的化学平衡常数是经验平衡常数,故在高考题中所考的平衡常数足有单位的。

- 全部评论(0)
