学法指导:元素及其化合物知识复习思路
时间:2020-03-05 12:52 来源: 作者:刘明 点击: 次 所属专题: 元素化合物
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
高考化学总复习一般分三轮展开:第一轮复习的主要内容是学科内主干知识的复习与学科能力的培养(一般安排在先年9月至次年3月),第二轮复习的主要内容是热点(或专题)复习与综合能力的培养(一般安排在次年3月至4月),第三轮复习的主要内容是套题训练与查漏补缺(一般安排在次年5月)。元素化合物知识是中学化学的重要组成部分,是其它版块研究的具体对象。从备考复习角度讲这部分知识也是高考命题的重要热点之一,况且化学实验、化学计算、化学原理等也常把元素化合物作为背景和载体。因此,复习中应把这部分内容放在必须导深、导活、导透的战略高度来认识。
由于元素化合物涉及到的知识点太多,且许多都是描述性的,内容繁杂零碎,需要理解和记忆的东西分散、不系统,因此复习使用起来不太容易。鉴于这些特点,在进行专题复习时应着重抓好如下几点。
一、深入研究教材和《考试大纲》,明确每个知识点的要求
每年的《考试大纲》都有细微的变化,但一些已经明确不要求的知识点(如HCl的实验室制法、H2S的性质、硝酸盐的化学性质)就没有必要再去“深挖洞”了;而一些与社会生活生产实际有密切的知识点(如O3、H2O2、光化学烟雾以及其它环境的污染与保护涉及到的知识)就必须高度重视。再比如铜及其化合物、酸式盐等知识,在教材中极其分散,《考试大纲》也没有明确要求,但从近年实际情况看必须进行深入研究。
下面是笔者设计的酸式盐知识专题复习内容:
(一)酸式盐的定义:酸式盐是多元酸中的氢离子部分被碱中和的产物,它由金属阳离子(或NH4+)和酸式酸根离子构成,例如KHSO4、NaHS、NH4HCO3等。
(二)酸式盐的类别:为了研究的方便,一般可把酸式盐分成强酸酸式盐(硫酸氢盐)、弱酸酸式盐(非硫酸氢盐)两大类。
(三)酸式盐的形成
1、不足量碱与多元酸反应,例如:H2SO4+NaOH==NaHSO4+H2O;
2、正盐与对应的酸反应,例如:Na2CO3+H2O+CO2==2NaHCO3;
3、弱酸正盐与少量强酸的反应,例如:Na2CO3+HCl==NaHCO3+NaCl;
4、过量的酸性氧化物跟少量的可溶性碱溶液反应,例如:CO2(过量)+NaOH==NaHCO3;
5、过量的酸性氧化物与少量相应酸的正盐或更弱酸的盐反应,例如:Na2CO3+CO2+H2O==NaHCO3 ;NaAlO2+CO2+2H2O==NaHCO3+Al(OH)3↓
(四)酸式盐在水中的溶解性:绝大多数的酸式盐易溶于水,而且酸式盐的溶解度大于正盐,例如Ca(HCO3)2>CaCO3、Mg(HCO3)2>MgCO3,但是碱金属元素中有例外——Na2CO3在水中的溶解度就比NaHCO3要大。
(五)酸式盐的化学性质
1、热稳定性
(1)热稳定性大小顺序一般为:正盐>酸式盐>对应酸,
例如:Na2CO3受热难分解、2 NaHCO3![]() Na2CO3+CO2+H2O、H2CO3=CO2↑+H2O。
Na2CO3+CO2+H2O、H2CO3=CO2↑+H2O。
(2)一般说来,多元弱酸(如H2CO3 、H2SO3)易分解,其酸式盐受热也易分解,
例如: 2NaHSO3=Na2SO3+SO2+H2O;多元酸较稳定,其酸式盐也较稳定,
例如:H2SO4较H2CO3稳定,则NaHSO4要较NaHCO3稳定。
2、酸式盐与碱的反应
(1)强酸的酸式盐
具有强酸的性质,例如:NaHSO4 +NaOH==Na2SO4+H2O(其离子方程式为H++OH-==H2O),
NaHCO3+NaHSO4== Na2SO4+CO2↑+H2O(其离子方程式为HCO3-+H+== CO2↑+H2)。
(2)弱酸酸式盐
弱酸酸式盐具有H+的某些性质,能与碱反应。
例如:NaHCO3 + NaOH == Na2CO3+H2O
(其离子方程式为HCO3-+OH-==CO32-+H2O),Ca(HCO3)2 + Ca(OH)2==CaCO3↓+H2O
(其离子方程式为Ca2++HCO3-+OH-==CaCO3↓+H2O)。
3、弱酸酸式盐与强酸的反应
例如:NaHCO3+HCl ==NaCl+CO2↑+H2O(其离子方程式为HCO3-+H+== CO2↑+H2O)。
当然,酸式盐仍然是盐,肯定能体现盐的某些性质——包括金属阳离子(或NH4+)和酸根离子的某些性质。
(六)酸式盐的水解与电离
1、酸式盐的水解
水解的规律是“有弱才水解、越弱越水解”,例如:HCO3- +H2O≒H2CO3+OH-。
弱酸酸式盐与某些弱碱强酸盐溶液混合时可能发生“双水解反应”,例如:AlCl3+3NaHCO3=====Al(OH)3↓+3CO2↑+3NaCl。
2、酸式盐的电离
(1)水溶液中
①NaHCO3==Na++ HCO3-、HCO3- H++CO32-
H++CO32-
②NaHSO4== Na++ H++ SO42-(或NaHSO4= Na++ HsO4-)
(2)熔化状态下
①2NaHCO3(熔)== Na2CO3+CO2+H2O(NaHCO3在熔化状态下不存在,要分解),
Na2CO3(熔)== 2Na++CO32-。
②NaHSO4== Na++ HsO4-。
3、酸式盐水溶液的酸碱性
酸式盐溶于水后,溶液的酸碱性与酸式阴离子的电离和水解程度的大小有关,如果电离大于水解,则溶液显酸性;如果电离小于水解,则溶液显碱性。所以酸式盐溶液不一定显酸性,相反,绝大多数酸式盐水溶液显碱性,只有HSO4-、H2PO4-、HSO3-等盐的水溶液显酸性。
(七)涉及酸式盐的常考题型
1、酸式盐与碱反应的离子方程式问题
(1)单纯“中和”,如前述NaHSO4 +NaOH ==Na2SO4+H2O的离子方程式为H++OH-=H2O,
NaHCO3 + NaOH = Na2CO3+H2O的离子方程式为HCO3-+OH-==CO32-+H2O ,
NaHCO3+NaHSO4== Na2SO4+CO2↑+H2O的离子方程式为HCO3-+H+== CO2↑+H2O。
(2)既“中和”又“沉淀”
①NaHSO4(少量)+Ba(OH)2的离子方程式为:H++SO42-+Ba2++OH-==BaSO4↓+H2O;
NaHSO4(过量)+Ba(OH)2的离子方程式为:Ba2++2OH-+2H++SO42-== BaSO4↓+2H2O。
②Ca(HCO3)2 + NaOH(少量)的离子方程式为: OH-+ Ca2++HCO3-== CaCO3↓+H2O;
Ca(HCO3)2 + NaOH(过量)的离子方程式为:Ca2++2HCO3-+2OH-== CaCO3↓+2H2O。
书写这类离子方程式的诀窍是“设少为1,以少定多”——设量少的物质为1mol,根据其电离产生的离子物质的量,确定量多物质有关离子的用量(它们需多少便有多少)。
但要注意:Mg(HCO3)2+NaOH(过量)的离子方程式为:Mg2++2HCO3-+4OH-== Mg(OH)2↓+2CO32-+2H2O,原因是Mg(OH)2比MgCO3更难溶。
2、离子共存问题
(1)弱酸的酸式盐离子(如HCO3-、HS-等),不能与H+或OH-大量共存。
(2)HCO3 -等弱酸酸式盐离子,在溶液中能与Al3+、Fe3+等离子发生双水解反应,因而不能大量共存。
注意AlO2-与HCO3-在溶液中也不能大量共存。这不是水解,而是因为AlO2-的水解促进了HCO3-的电离,其离子方程式为:AlO2-+HCO3-+H2O==Al(OH)3↓+CO32-。
(3)HS-、HsO3-等酸式盐离子通常具有还原性,因而不能与Fe3+、ClO-等具有强氧化性的离子大量共存。
3、推断题。限于篇幅,这里从略。
二、充分运用理论的指导作用,把每个知识点导深、导活、导透
复习必须“树魂立根”——树化学理论之魂、立元素及其化合物知识之根,充分运用理论的指导作用,才能把每个知识点导深、导活、导透。重要的理论包括:
1、氧化还原反应理论:主要解决物质是否具有氧化性、还原性及其强弱等。例如,元素处于最低价态时只可能具有还原性、处于最高价态时只可能具有氧化性、处于中间价态时既可能具有还原性又可能具有氧化性。一般说来,元素处于高价且对应物质不稳定就具有强氧化性,如HClO、浓H2SO4、HNO2及其盐、HNO3及其盐;但如果物质稳定,即使元素处于最高价也没有强氧化性,如HClO4及其盐(ClO4-稳定)、稀H2SO4及其盐(SO42-稳定)。
2、离子反应理论和电解质溶液理论:主要解决溶液中离子的种类和浓度、溶液的酸碱性、离子之间是否发生反应——包括离子互换反应、氧化还原反应、双水解反应和络合反应等。例如FeCl3溶液的性质可以从以下方面去考虑:Cl-的性质(沉淀性及还原性)、Fe3+的性质(沉淀性、水解性、氧化性、络合性);又如新制氯水的性质可以从以下方面去考虑:
成分 | H2O | Cl2 | HClO | H+ | Cl- | ClO-、OH-(微量) |
性质 | 与CuSO4等反应 | 与Fe2+、Br-等反应 | 强氧化性及漂白性 | 酸的通性 | 沉淀性及还原性 |
3、元素周期律理论:主要解决元素及其化合物的基本性质,例如元素的金属性非金属性、同周期元素及其化合物的递变性、同主族元素及其化合物的相似性与递变性等。
4、化学键理论和晶体结构理论:主要解决物质结构、化学活性、稳定性、熔沸点、硬度、溶解性等。
5、化学反应速率与化学平衡理论:主要解决化学反应的快慢与进行的程度。
在复习每种物质(知识点)时,应引导学生按以下程序进行联想:
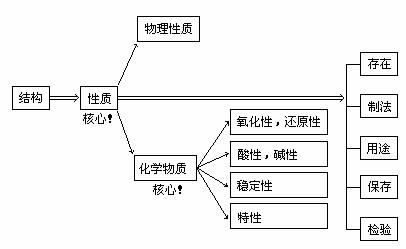
三、抓住两条主线,构建知识网络
在复习元素的单质及其化合物时首先列出以下两条知识主线:
(一)非金属知识主线(六种)
气态氢化物←单质→氧化物→对应水化物→相应含氧酸盐
气态氢化物 | 单质 | 氧化物 | 对应水化物 | 相应含氧酸盐 |
HCl | Cl2 | Cl2O | HCl | NaClO、Ca(ClO)2 |
H2S | S | SO2、SO3 | H2SO3、H2SO4 | Na2SO3 、Na2SO4 |
NH3 | N2 | NO、NO2 、N2O5 | HNO3 | NaNO3、Cu(NO3)2 |
PH3 | P | P2O5 | HPO3、H3PO4 | Ca3(PO4)2 、Ca(H2PO4)2 |
CH4 | C | CO、CO2 | H2CO3 | CaCO3 、Ca(HCO3)2 |
SiH4 | Si | SiO2 | H4SiO4 、H2SiO3 | Na2SiO3 、CaSiO3 |
(二)金属知识主线(五种)
单质→氧化物→对应水化物→相应盐
单质 | 氧化物 | 对应水化物 | 相应盐 |
Na | Na2O、Na2O2 | NaOH | Na2CO3 、NaHCO3 |
Mg | MgO | Mg(OH)2 | MgCl2 、Mg(HCO3)2 |
Al | Al2O3 | Al(OH)3 | Al2(SO4) 3 、NaAlO2 |
Fe | FeO、Fe2O3、Fe3O4 | Fe(OH)2 、Fe(OH)3 | FeSO4 、Fe2(SO4)3 |
Cu | Cu2O、CuO | Cu(OH)2 | CuSO4 |
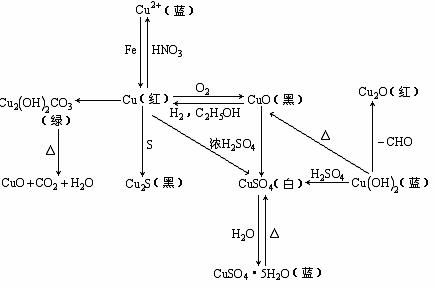
在此基础上再构建知识网络,例如铜及其化合物:
四、把握各类物质性质的一般规律,注意特殊性
中学无机化学重点研究的物质有单质、氢化物、氧化物、酸、碱、盐六大类。
1、单质
(1)结构:分子组成可分为单原子分子、双原子分子、多原子分子。晶体结构可分为:分子晶体、原子晶体、金属晶体。
(2)性质
①金属单质:由于最外层电子数一般少于4个,易失去外层电子而达到稳定结构,所以容易表现出还原性,不会表现氧化性,主要研究与氧化性物质的化学反应,故一般研究其与非金属单质、氢化物(包括H2O)、高价态氧化物(如CO2)、酸(分氧化性酸和非氧化性酸)和盐的反应。当然也要注意一些特殊的反应,如某些金属(如Al)可与强碱溶液反应,又如某些金属(如Fe和Al)与浓H2SO4、浓HNO3会发生钝化等。
②非金属单质:由于最外层电子数一般比较多,易得到电子达到稳定结构,容易表现出氧化性(当然也可以表现出还原性),主要研究与还原性物质的化学反应,故一般研究其与金属单质、非金属单质(如H2)、氢化物(如H2O)、氧化物(一般是金属氧化物)、酸、碱和盐的反应,也要注意一些特殊的反应,如Si与HF、C与浓H2SO4或浓HNO3等。
2、氢化物
(1)结构:分族研究,各族都有特定的结构,如第Va族氢化物是三角锥形。另外F、O、n(与)H原子之间可形成氢键,会使物质的一些性质(如熔点、溶解度)表现出特殊性。
(2)性质
①金属氢化物:主要研究其与水反应生成碱和H2。其本质是金属氢化物中—1价的氢与水中+1价的氢之间发生归中反应。
②非金属氢化物:先判断水溶液的酸碱性,若水溶液显酸性,则一般可以表现酸的通性,可与单质、氧化物、碱反应。其次非金属氧化物易表现还原性,注意MnO2与浓盐酸,SO2与H2S,NH3与CuO,H2O与F2等的反应。
3、氧化物
(1)分类
酸性氧化物(包括Mn2O7等)
成盐氧化物 ![]() 碱性氧化物
碱性氧化物
两性氧化物(Al2O3)
不成盐氧化物(CO、NO)
过氧化物等特殊氧化物
(2)非氧化还原通性
①酸性氧化物:与水反应只生成酸,与碱性氧化物反应只生成盐,与碱反应只生成盐和水,与某些盐反应。
②碱性氧化物:与水反应只生成碱,与酸性氧化物反应只生成盐,与酸反应只生成盐和水,与某些盐反应。
③两性氧化物:兼有酸性氧化物、碱性氧化物的性质。
(3)氧化性还原性
氧化物里中心元素的化合价决定了氧化物的氧化性和还原性。若处于中间价态,则一般既可表现氧化性、又可表现还原性;若处于最高价态,则只能表现氧化性。例如H2O2跟强氧化性物质(如KMnO4/H+)作用表现还原性,与强还原性物质(如H2S)作用表现氧化性。
4、酸
酸分为含氧酸和无氧酸,又可分为非氧化性酸、氧化性酸和还原性酸,还可分为挥发性酸和高沸点酸,强酸和弱酸,一元酸和多元酸。
(1)一般性:①与酸碱指示剂作用;②含氧酸一般由酸酐与水反应得到,一般溶于水,放出大量热,并电离出H+和相应酸根离子;③酸能与碱性氧化物、碱反应生成盐和水;④酸能与活泼金属发生置换反应放出H2;⑤酸能与某些盐发生复分解反应生成新盐和新酸。
(2)特殊性:①一些氧化性酸与酸碱指示剂先显色后褪色;②H2SiO3不溶于水,且不能由SiO2与水反应得到;③与碱或碱性氧化物反应生成的盐不一定是正盐;④强氧化性酸与金属反应,不一定是置换反应;不一定放出气体;放出的气体也不一定是H2。
5、碱
(1)一般性:①与酸碱指示剂作用;②可溶性碱可由碱性氧化物与水反应得到;碱溶于水放出大量热,不溶性碱受热易分解;③可与酸性氧化物、酸反应生成盐和水;④碱可与一些非金属单质发生歧化反应;⑤碱能与某些盐发生复分解反应生成新盐和新碱。
(2)特殊性:①强碱可与铝反应生成H2;②碱可使某些沉淀溶解,如NaOH溶液可溶解Al(OH)3沉淀,氨水可溶解AgOH沉淀(得到银氨溶液)。
6、盐
(1)水溶性:钠盐、钾盐、铵盐均溶于水。碳酸盐大都不溶于水,而碳酸氢盐一般易溶于水。
(2)氧化性、还原性:①常见氧化性盐:Fe3+盐、KMnO4/H+、NaClO;②常见还原性盐:KI、Na2S、Na2SO3、Fe2+盐。
(3)特殊颜色:Fe3+(黄色)、Fe2+(浅绿色)、Cu2+(蓝色)、AgCl(白色)、AgBr(淡黄色)、AgI(黄色)、CuS(黑色)。
五、抓好“三个结合”,注重纵横联系
元素及其化合物知识不仅与基本理论密切相关,也与实验、计算以及生产生活实际有密切的联系,在复习元素及其化合物时要将这三块内容穿插其中,使元素及其化合物知识与实验、计算以及生产生活实际融为一体。
1、与实验结合
化学是一门以实验为基础的学科,实验中除基本操作外,试剂保存、仪器洗涤、物质的制备、分离和提纯、检验、定量实验,特别是性质实验无不与元素化合物知识有关。复习元素及其化合物时,如果能结合一些典型实验进行教学,不但能提高学习兴趣,而且还能加深对知识的理解和运用。与实验结合结合时,要特别注意综合与创新。
实例1:在复习“Fe2+”和“Fe3+”的相互转化关系时,可设计如下两组实验:(1)向新制的FeCl2溶液中滴加几滴KSCN溶液,溶液无明显变化,再向其中滴加氯水,观察现象;(2)取四支分别盛有FeCl3溶液的试管,再向其中三支试管中分别加入少量Fe粉,铜粉、KI溶液,观察产生的现象;并写出上述两组实验的有关反应方程式。通过上述实验,既复习了“Fe2+”和“Fe3+”的性质和相互转化关系,又复习了 “Fe2+”和“Fe3+”的检验。
实例2:使氯气依次通过湿的色布、浓硫酸、干燥的有色布条、FeCl3溶液、氢硫酸、KI 淀粉溶液和NaOH溶液,各有什么现象?指出NaOH溶液的3个作用,写出有关化学方程式。这就把氯气的许多性质联系起来复习了。
实例3:对SO2气体的性质可通过下列实验进行——SO2通入哪种溶液中会出现下列现象:(A)使澄色溶液变为无色;(B)使棕黄色溶液变为无色;(C)使紫色溶液变为红色;(D)使红色溶液变为无色,但加热后又变为红色;(E)使无色溶液变为浅黄色沉淀;(F) 使无色溶液出现白色沉淀,继续通入过量的SO2,白色沉淀逐渐溶解。通过对问题的分析与实验,把SO2的主要性质,即与溴水、FeCl3、石蕊、品红、氢硫酸、澄清石灰水等物质的反应得到全面复习。
2、与计算结合
复习元素及其化合物的性质时,将定性深化为定量是必不可少的,与计算结合,既巩固加深了对物质性质的理解和运用,又可提高学生的分析和计算能力。例如ClO2、Cl2都是强氧化剂,都可以消毒杀菌,与同质量的Cl2相比,ClO2具有更高的消毒效率计算相同质量的ClO2消毒效率是Cl2的多少倍。又如在复习氮氧化物知识时,应穿插NO、NO2、O2、H2O反应的有关计算。
3、与生产生活实际结合
在复习中,应尽可能将元素及其化合物知识与生产、生活、环境、自然、能源等实际问题紧密联系起来,使学生感到化学知识是有源之水、有本之木,学习化学知识不仅仅是为了应试,更重要的是具有实际的意义。同时,这也是激发学生学习兴趣的重要途径。
六、渗透重要的化学思想,提高学生的思维能力
1、分类的思想:分类思想就是根据研究对象本质属性的相同点与不同点,将其分成几个不同种类的一种科学思想。它既是一种重要的科学思想,又是一种重要的逻辑方法。分类的思想是学习中最常用也最有用的思想,它能将知识系统化,是寻找共性的基础。例如我们在前面就将中学无机化学涉及的物质分成了单质、氢化物、氧化物、酸、碱、盐六大类去研究。
2、同中求异、异中求同的思想:在创造性思维活动中,求异思维占主导地位,也有求同的成分,而且两者是密切结合的。在复习中,只有引导学生同中求异与异中求同的反复结合,才能培养思维的流畅性、变通性、新奇性。例如对一类物质,我们可以先分析它们的通性,再去寻找某些个体的特性。
3、对比的思想:将不同物质从多角度进行对比,不仅有助于记忆,而且能体现二者的区别。在元素化合物中有一些元素化合物之间存在着相同点、不同点和相互联系,容易引起混淆,对于这些物质,可采用比较法,进行综合分析,一一进行对照比较分析,找出其共性和差异,以获得牢固、系统、准确的知识。例如液氯和氯水的比较、盐酸和氯化氢的比较、三大强酸的比较、Na2CO3与NaHCO3的比较、Na2O与Na2O2的比较。
4、类比的思想:类比是依据两个对象之间存在着某些相同或相似的属性,推出它们存在其它相同或相似的属性的思维方法。例如对于同一主族的元素或处于对角线位置的元素,性质常常十分相似,运用类比思想,便可推出未学元素的一些性质。
5、归纳的思想:归纳推理是从具体的前提过渡到一般性的结论的推理。它有两种功能,一是概括一般情况,二是推测将来结果,其结论都超越了前提的范围。例如对置换反应可作如下归纳:
(1)同主族元素单质之间的置换反应:
ⅠA: Na、K→H2 Na→K
ⅣA: C→Si
ⅥA: O2→S
ⅦA: Cl2→Br2、I2 Br2→I2
(2)不同主族元素单质之间的置换反应:
①碱金属单质以外的金属单质置换H2:
Mg、Al→H2 Al、Si→H2 C→H2
②卤族元素单质与氧族元素单质之间的置换:
F2→O2 Cl2→S
③卤族元素单质与氮族元素单质之间的置换:
Cl2→N2
④氧族元素单质与氮族元素单质之间的置换:
O2→N2
⑤其他
Mg→C H2→Si
(3)过渡元素单质参与的置换反应:
①置换出氢气:
Zn、Fe→H2 Fe→H2
②非金属单质置换出金属:
H2→Cu、Fe C→Cu、Fe Si→Fe
③铝热反应:Al与比它活泼性差的金属氧化物之间的置换。
④金属单质置换出金属单质:遵循金属活动顺序表。
复习有法但无定法。元素化合物的复习,重在方法的指导和典型知识的归纳总结、并关注各类知识间的相互渗透,力求达到知识的有序储存和有序检索,努力提高学生的综合能力。

- 全部评论(0)
