碳酸钠与盐酸定性与定量考查
时间:2016-05-16 10:57 来源:未知 作者:万胜 点击: 次 所属专题: 碳酸钠与盐酸
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
1、定性考査
1) “互滴”现象的考查
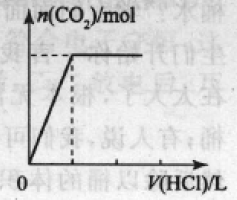
①将碳酸钠溶液加人盐酸中,发生反应是:Na2CO3+2HCl = 2NaCl+H2O+CO2
产生的现象:立即产生气泡。
对应的图象:如右图所示
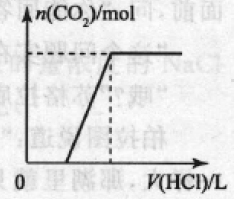
②将盐酸加人碳酸钠溶液中,发生反应是:Na2CO3 + HCl =NaHCO3 + NaCl,NaHCO3 + HCl = NaCl+H2O+CO2
产生的现象:刚开始无气泡产 生,继续滴加,一段时间后有气 泡产生。
对应的图象:如右图所示。
例1:只用胶头滴管和试管,不用其他试剂就可以区别的1组溶液(浓度均为 0. 1 mol/ L)是( )
A. CaCl2 和 Na2CO3;
B.稀 HCl 和 Na2CO3;
C.Ba(OH)2 和 NaHCO3;
D.AlCl3和盐酸
解析:根据滴加的顺序不同,产生的现象不同加以 区别,选项A、D直接排除.选项B中若将稀HC1滴人Na2CO3溶液中,产生HCO3- ,无明显现象; 若将Na2CO3溶液滴人稀HC1中,则有CO2产生。选项D中AlCl3溶液滴人盐酸中,无沉淀产生;而将盐酸滴入AlCl3溶液中,也无沉淀产生。
答案B.
例2: Na2CO3溶液中逐滴滴入稀盐酸,溶液中的HCO3-浓度的变化情况是( )
A逐渐增大;
B逐渐变小;
C先逐渐增大而后减小;
D先逐渐减小后变大
解析:向饱和Na2CO3溶液中逐滴滴人稀盐酸, CO32-与H+先结合生成HCO3-, HCO3-浓度增大;继续滴加盐酸时,HCO3-与多余的H+结合放出CO2,HCO3-浓度逐渐减少,正确选项为C.
答案C.
例 3 :将 0. 4 g NaOH 和 1. 06 g Na2CO3 混合并 配成溶液,向溶液中滴加0. 1 mol/L稀盐酸。下列图象能正确表示加入盐酸的体积和生成co2的物质的量的关系的是( )
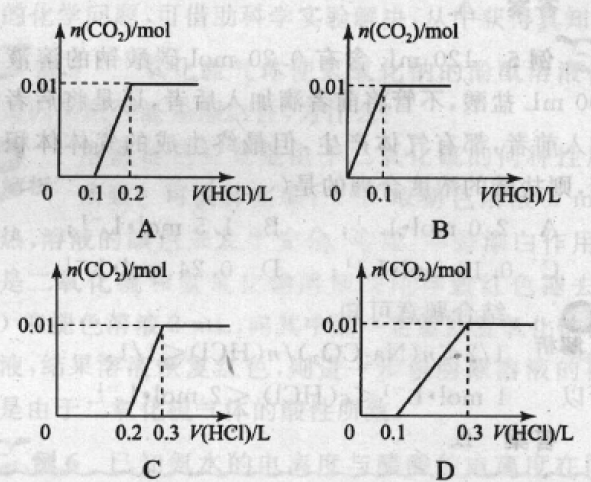
解析:向NaOH和Na2CO3混合溶液中滴加盐酸 时,盐酸首先和NaOH反应生成水和氯化钠,当滴人0.1 L时,两者恰好反应完全;继续滴加时,盐酸和Na2CO3开始反应,首先发生HCl + Na2CO3 = NaHCO3 + NaCl,不放出气体,当再加入 0.1 L盐酸时,此步反应进行完全;继续滴加时,发生 NaHCO3 + HCl=NaCl+H2O + CO2 反应,此时开 始放出气体;分析图象,可知答案为C.
2、定量考査
结合互滴的化学方程式,可知:当n(Na2CO3)/ n(HCl)<l/2时,无论谁滴谁,最终产生的CO2的量 一定相同;当n(Na2Co3)/n(HCl)>l/l时,碳酸钠溶液加入盐酸中会产生气体,盐酸加人碳酸钠溶液中有无气体生成;当 l/2<n(Na2CO3)/n(HC1<1/1 时, 2种情况都会产生气体,但碳酸钠溶液加入盐酸产生的气体要多于盐酸加入碳酸钠溶液产生的气体。
例4:①将0.100 L 1.00 mol/L的纯碱溶液 逐滴滴入0.100 L 1.25 mol/L的盐酸中;
②将0. 100 L 1.25 mol/L的盐酸逐滴滴入 0. 100 L 1.00 mol/L的纯碱溶液中;
2种操作产生CO2的体积比为( )
A 5:2;B 2:5;C 2:1; D 1:1
①中 n(Na2CO3)/n(HCl) =0. 1:0. 125 =1:1. 25,用盐酸计算 Na2CO3〜2HC1 〜CO2, n1(CO2) =0. 0625 mol;
②Na2CO3 + HCl=NaHCO3 + NaCl、
0.1 0.1 0.1
NaHCO3 + HCl =NaCl+H2O +CO2
0. 1 0. 125-0. 1 0. 125-0. 1
n2(CO2) =0. 025 mol
n1(CO2):n2(CO2)=5:2.
答案A.
例 5: 120 mL含有0. 20 mol碳酸钠的溶液和 200 mL盐酸,不管将前者滴加人后者,还是将后者滴 加入前者,都有气体产生,但最终生成的气体体积不 同,则盐酸的浓度合理的是( )
A 2. 0 mol/L ; B 1. 5 mol/L ;C 0. 18 mol/L ; D 0. 24 mol/L
解析:结合题意可知, l/2<n(Na2CO3)/n(HCl)<l/l,所以 1 mol/L<c(HCl) <2 mol/L.
答案B.
链接练习
1.甲试管中盛有0.5 mol/L Na2CO3溶液10 mL,慢 慢往试管中加入1 mol/L的盐酸7.0 mL;乙试管中盛 有1 mol/L的盐酸7.0 mL,慢慢往试管中滴加0.5 mol/L Na2CO3溶液10 mL,那么甲、乙两试管中产生 的CO2物质的量大小关系为( ).
A 甲等于乙
B 甲大于乙
C 甲小于乙
D 无法确定
2. 向0. 14 mol Na2CO3溶液中逐滴加入含一定量HCl 的稀盐酸,经充分反应后,溶液中各溶质的物质的量判断可能正确的是( ).
A 生成 0. 2 mol NaCl 和 0. 08 mol NaHCO3
B 剩余 0. 04 mol Na2CO3,得 0. 20 mol NaCl;
C 剩余 0. 06 mol HCl,得 0. 14 mol NaCl 和 0. 14 mol NaHCO3;
D 生成 0. 06 mol NaCl 和 0. 08 mol NaHCO3
链接练习参考答案
1. C. 2. A.

- 全部评论(0)
(710216615) 评论 href="/plus/view.php?aid=15997">碳酸钠与盐酸定性与:可以可以,这很可以
