用盐酸探究氢氧化钠溶液的变质程度
时间:2016-05-16 12:34 来源:未知 作者:李从山 点击: 次 所属专题: 碳酸钠与盐酸 氢氧化钠变质
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
初中化学试题中经常出现以盐酸作为载体,来 探究氢氧化钠溶液在空气中的变质程度的试题,这 类题目的解析思路往往是NaOH吸收空气中的CO2而变质生成Na2CO3,逐滴加入盐酸后根据是否立即产生气体还是加入一定量盐酸后才产生气体 这两种反应现象,简单地判断NaOH是部分变质还 是全部变质,从而形成一系列的计算问题。
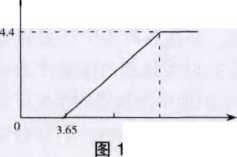
例1 (沪教化学课本第208页第16题)有一 瓶在空气中敞口放置了一段时间的NaOH溶液。某实验小组欲测定 其变质情况,取 l00mL该溶液, 向其中逐滴滴加盐酸,产生气体 的质量与加入盐 酸的溶质的质量关系如图1所示。
据此推测:
(1)该瓶溶液中溶质NaOH是否完全变质,为 什么?
(2) 计算100m L该溶液中参加反应的碳酸钠的质量。
根据教材编者的意图,教材给出的第一个问题 的解题思路是开始滴入HC1没有气体生成的阶段 当作NaOH与HC1反应的过程,然后再由NaOH变 质生成的Na2CO3与HCl反应放出CO2的过程,从而给出NaOH溶液部分变质的结论。教材给出第二 个问题的解题思路是Na2CO3与HC1反应产生4.4g CO2,从而得出Na2CO3的质量为10.6g,消耗盐酸为 7.3g。需要说明的是此处与Na2CO3反应的盐酸质量 恰好为横坐标酸量10.95g-3.65g,说明题中给出横 坐标酸量即为盐酸溶质质量。
这里我们要明白,按照上面所描述的解题过程 中已经忽略了两个问题:其一是开始滴入HC1没有 气体生成的阶段是否就是NaOH与HC1反应的过 程;其二是滴入HC1恰有气体生成时是否就是Na2CO3与HC1反应产生CO2的过程。
基于以上两个问题,我们先进行以下问题的分析:
一、问题1.往Na2CO3溶液中逐滴滴入盐酸与 往盐酸中逐滴滴入Na2CO3溶液两者现象比较
往Na2CO3溶液中逐滴滴入盐酸时,首先发生反 应:Na2CO3+HCl=NaHCO3,此阶段不产生CO2,当 Na2CO3完全转化为NaHCO3后,再继续逐滴滴入盐 酸时才会有CO2生成,发生反应:NaHCO3+HCl = NaCl+H2O+CO2 ,两个过程所消耗的盐酸质量比为 1 : 1。现象为先无气泡产生后有气泡产生,即盐酸 滴到总盐酸量一半时才有CO2气体产生。
往盐酸中逐滴滴入Na2CO3溶液时’发生反应: Na2CO3+HCl= NaHCO3 +NaCl,由于此时盐酸是过 量的,立即会发生反应:NaHCO3+HCl= NaCl+H2O +CO2,即往盐酸中逐滴滴入Na2CO3溶液现象为立即有气泡产生,即立即有CO2气体产生。
二、问题2.用盐酸探究氢氧化钠溶液在空气中变质
1. 氢氧化钠溶液在空气中变质程度分析,由于空气中的CO2与氢氧化钠溶液反应的量不确定,因此,氢氧化钠溶液吸收空气中的CO2后, 所得溶液中溶质存在以下几种可能:
(1)NaOH、Na2CO3; (CO2 不足,NaOH 过量)
(2) Na2CO3; (CO2恰好与NaOH完全反应, NaOH恰好完全变质成Na2CO3)
(3) Na2CO3、NaHCO3;(CO2 足量,NaOH 完全变 质成 Na2CO3、NaHCO3)
(4)NaHCO3; (CO2过量,NaOH完全变质成 NaHCO3)
2. 用盐酸探究氢氧化钠在空气中变质
若氢氧化钠溶液变质程度为二.1中(1)的情 况,由于过量的NaOH也要消耗盐酸(且该过程没有气体放出),则向原氢氧化钠溶液中逐滴滴入盐 酸至刚好产生气体时所消耗的盐酸的质量要超过所加入酸总量的一半(如图2A)。
若氢氧化钠溶液变质程度为二.1中(2)的情 况,逐滴滴入盐酸时,由于变质生成的Na2CO3与盐 酸反应先生成NaHCO3(该过程没有气体放出),后反应生成的NaHCO3与盐酸作用有气体放出,这两个过程所消耗的盐酸质量比为1 : 1,则逐滴滴入 盐酸至变质溶液刚好产生气泡时所消耗的盐酸的质量等于所加入酸总量的一半(如图2B)。
若氢氧化钠溶液变质程度为二.1中(3)的情 况,由于先发生Na2CO3与盐酸反应生成NaHCO3(该过程没有气体放出),此过程中消耗的盐酸量比后进行的与NaHCO3反应(有气体放出)消耗的盐酸量少,则可得逐滴滴入盐酸至刚好产生气体时所 消耗的盐酸量小于所加入酸总量的一半(如图2C)。
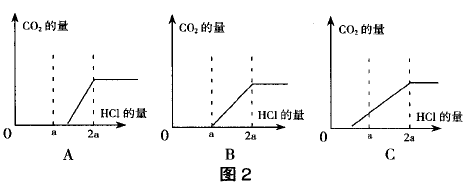
若氢氧化钠溶液变质程度为二.1中(4)的情 况,最为简单,当刚滴入盐酸时立即有气体产生。
在以上两点分析的基础上,我们再来研究例题 中的有关盐酸用量和产生量CO2量的关系。由于刚开始有气泡产生时消耗的酸液占总量的1/3,则与二.1第(3)种情况相符。分析可知,所取溶液中溶质 应当是Na2CO3和NaHCO3,即NaOH已变质完全, 显然跟教材结论矛盾。且根据问题2有关情况结合图像分析可知与Na2CO3反应生成NaHCO3消耗的 酸量占酸液总量的1/3,即为3.65 g,原有的Na2CO3 完全转化为NaHCO3。而后与NaHCO3反应所消耗 的HC1的量占酸液总量的2/3,为7.3 g,则理论上可 产生CO2质量为8.8g,亦跟教材图中产生的4.4 g CO2相矛盾。因此,若我们将盐酸的用量作为解题 依据,认为教材习题的图像中所描述的情况应该是 NaOH已完全变质成Na2CO3和NaHCO3,且最终反 应生成CO2质量的点应“上移”到8.8 g 处,如图3 所示较为合理。
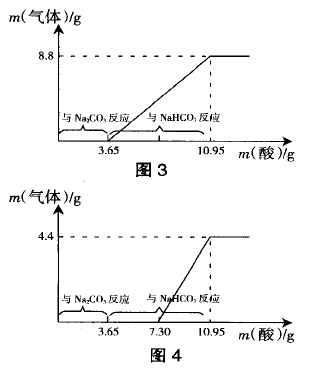
针对此题中出现的矛盾 我们做出如下 解释:按教材编 者的意图,NaOH溶液为部分变质,则与 NaOH反应的盐 酸量为3.65g,要 产生 4.4g CO2 需消耗盐酸量 为7.3 g,按问题2中Na2CO3与HCl反应时的原理来分析,此7.3 g 酸一半与Na2CO3反应生成NaHCO3, 一半再与反应生成的NaHCO3作用生成CO2。 因此教材习题的图像中,刚开始有气泡冒出的点应 当要“后推”,且反应过程中消耗的盐酸量在理论上 可按图4进行处理。
我们再来看2004年南通市的一道中考题,就巧妙的设计了解题思路,避免了上述矛盾的出现。
例2 (2004年南通中考题)研究性学习:探究 实验室中久置的NaOH的变质程度
研究方案:先称取13.3g的NaOH样品(杂质 为Na2CO3),配成溶液,然后向溶液中逐滴加入质量 分数为14.6%的稀盐酸,根据生成CO2的质量测定 Na2CO3的质量。从而进一步确定样品中NaOH的变 质程度。
解决问题:实验测得加入稀盐酸的质量与产 生CO2气体的质量关系如图所示。填写下表:(计算 结果保留小数点后一位)

继续探究:求实验过程中与NaOH反应所用盐酸的质量。
发现问题:根据“与NaOH反应所用盐酸的质 量”,对照图像,你发现了什么问题?
解析:由图像可得逐滴滴入盐酸至刚好产生气 体时所消耗的盐酸的质量要超过所加入酸总量的 一半,即所得溶液中的溶质为2.1中(1)的情况,其实这在题目已知条件中已给出,从一定程度上来 说,降低了本题目的难度系数。
解决问题设:所得溶液中Na2CO3的质量为 x,变质NaOH的质量为y
Na2CO3+2HCl=2NaCl+H2O+CO2
106 44
x 2.2g
106 : 44=x:4.4g
解得 x =5.3g
2NaOH + CO2=Na2CO3 + H2O
80 106 y 5.3g
80 : 106 = y :5.3g
解得y=4.0g
变质前 NaOH 的质量为 13.3 g -5.3 g +4.0 g=12g
NaOH 的变质程度为 4.0g H- 12g=33.3%
继续探究:设实验过程中与NaOH反应所用 盐酸的质量y
NaOH + HCl=NaCl + H2O
40 36.5
13.3 g -5.3 g y ×14.6%
40 : 36.5=8 g : (y × 14.6%)
解得:y=50 g
发现问题当NaOH被中和后,继续滴加盐酸为什么没有立即产生CO2气体?
现在我们从用酸量的角度来分析,根据题中的盐酸用量与产生CO2气体的图像,依据问题2的讨 论,我们可以得出其符合第(1)种情况,即NaOH溶 液部分变质的结论,原溶液中溶质有NaOH和 Na2CO3。此题中当NaOH被中和后,继续滴加盐酸 首先发生反应:Na2CO3+HCl=NaHCO3,此阶段不产 生CO2,当Na2CO3完全转化为NaHCO3后,再继续 滴入盐酸时就会有CO2生成,发生反应:NaHCO3+HCl=NaCl+H2O+CO2 ,两个过程所消耗的盐酸质 量比为1:1。由此可得刚有CO2生成时盐酸的质量为62.5 g,而并不是盐酸质量为50 g 时,我们上面 给出的详细解析过程是从CO2生成量的角度进行 的,可见两者结果是相符的。此题中两种解析过程 并不相驳,试题巧妙地设计了解题思路,充分考虑 了例1和例2所讨论的有关情况,该题反应过程 中消耗的HCl对应的量在理论上是按图4进行处 理的。
因此,用盐酸探究氢氧化钠溶液在空气中的变质程度的试题时,不能简单地认为:一是刚开始滴 入HCl没有气体生成的阶段一定是NaOH与HCl 反应,也有可能是盐酸与变质后的Na2CO3反应生 成NaHCO3的过程,二是滴入HCl恰有气体生成时 并不是Na2CO3与HCI反应产生CO2的过程,而是 NaHCO3与HCl反应产生CO2的过程。

- 全部评论(0)
