氨 硫酸 硝酸知识要点
时间:2017-08-08 19:35 来源:未知 作者:黄元 点击: 次 所属专题: 浓硫酸 硝酸 氨气
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
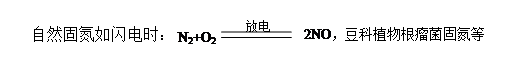
一、氮的固定
氮气转化为氮的化合物称为氮的固定。分自然固氮和人工固氮
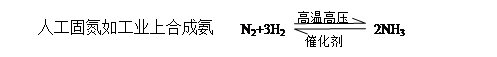
二、氨
1、氨的组成
分子式:NH3, 相对分子质量:17 摩尔质量:17g/mol
2、氨的物理性质
[实验4-8]氨的喷泉实验
实验内容 | 实验现象 | 解释与结论 |
教材实验4-8 | 形成红色喷泉 | 氨气易溶于水,少量水溶解了大量氨气,烧瓶内气压减小,大气压将水压入烧瓶。 氨水显碱性,酚酞遇碱显红色 |
氨的物理性质:无色、刺激性气味的气体,易溶于水(1:700),密度比空气小。
3、氨的化学性质:
(1)氨溶于水时,部分与水反应:
NH3+H2O![]() NH3·H2O
NH3·H2O
NH3·H2O可电离出氢氧根离子,使溶液显碱性
NH3·H2O![]() OH-+NH4+
OH-+NH4+
NH3·H2O不稳定,受热分解NH3·H2O![]() NH3↑+H2O
NH3↑+H2O
(2)氨与酸的反应:
[实验]分别蘸有氨水与浓盐酸的两玻璃棒靠近。现象:产生白烟
解释:氨水挥发出氨气,浓盐酸挥发出氯化氢气体,二者在空气中相遇生成氯化铵固体小颗粒,形成白烟。NH3+HCl=NH4Cl
换为硝酸,也有类似现象,因为硝酸有挥发性.NH3+HNO3=NH4NO3
换为硫酸,没有类似现象,因为硫酸没有挥发性。
(3)氧化还原性
NH3中氮元素处于-3价,只有还原性。
如:4NH3+5O2![]() 4NO+6H2O 氧化剂O2、还原剂NH3
4NO+6H2O 氧化剂O2、还原剂NH3
[NH3中氮元素处于+1价,只有还原性。如NH3+Na=NaNH2+H2↑]
(4)分解(合成氨反应的逆反应)
三 、铵盐
1、物理性质:易溶于水的晶体。
2、化学性质:(1)与碱反应生成氨气:NH4NO3+NaOH![]() NH3+H2O+NaNO3
NH3+H2O+NaNO3
(2)受热分解:NH4Cl![]() NH3↑+HCl↑ NH4CO3
NH3↑+HCl↑ NH4CO3![]() H2O↑+CO2↑+NH3↑
H2O↑+CO2↑+NH3↑
注意,并不是所有铵盐都按这种方式分解。如硝酸铵分解复杂。
3、铵盐的检验:加氢氧化钠浓溶液加热,生成使湿润的红色石蕊试纸变蓝色的气体。说明是铵盐,离子方程式为NH4++OH-![]() NH3↑+H2O
NH3↑+H2O
四、氨气的制取
1、工业上:高温高压和催化剂存在时氮气与氢气反应。
2、实验室(通常):原理:2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O
装置:固 +固![]() 气 (与用氯酸钾制氧气相似)
气 (与用氯酸钾制氧气相似)
干燥:碱石灰
收集:向下排空气法
验满:湿润的红色石蕊试纸或蘸浓盐酸的玻璃棒或湿润的酚酞试纸。
多余氨气可用水或酸吸收。
也可以将浓氨水滴入氧化钙或氢氧化钠固体、加热浓氨水等方法制备氨气。
五、硫酸
(一)稀硫酸的性质:酸的通性
H2SO4=2H++SO42-如
1.与铁反应:2H++Fe=Fe2++H2↑
2.与氢氧化钠溶液反应:H++OH-= H2O
3.与氨反应:H++NH3=NH4+
4.与氢氧化铝反应:Al(OH)3+3H+=Al3++3H2O
5.与氧化铝反应:Al2O3+6H+=2Al3++3H2O
6.与碳酸钠溶液反应:2H++CO32-= H2O +CO2↑
(二)浓硫酸的特性
浓硫酸除了仍然有酸性外,还有其特性
(1)吸水性:H2O被浓硫酸吸收。这是浓硫酸做干燥剂的原理。浓硫酸可以干燥氧气、氢气、CO、氮气、Cl2、HCl、SO2等中性或酸性气体。不能干燥氨气(碱性气体)、H2S等强还原性气体
(2)脱水性:浓硫酸将有机物分子中的氢氧原子变成水而使之脱下(浓硫酸做脱水剂),如:
![]()
实验内容 | 现象 | 解释与结论 |
浓硫酸与蔗糖作用 | 蔗糖先变黄再变黑,然后生成的黑色物质体积膨胀为疏松多孔状,并产生白雾,烧杯发烫。有刺激性气味。 | 浓硫酸使蔗糖脱水,并放热。黑色固体是碳单质。反应产生气体为二氧化硫和二氧碳。 |
稀硫酸与蔗糖作用 | 蔗糖溶解,无其它现象 | 蔗糖溶解在稀硫酸的水中 |
(3)强氧化性
①氧化非金属C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O
②氧化金属
实验内容 | 现象 | 解释与结论 |
A浓硫酸与铜混合 | 无明显现象 | 浓硫酸与铜常温下不反应 |
B浓硫酸与铜混合后加热 | 铜表面先变黑,后溶解,产生白色固体,有刺激性气味气体生成 | Cu+2H2SO4(浓) |
C将b生成的气体通入品红溶液中 | 品红溶液褪色 | 浓硫酸与铜混合后加热有二氧化硫生成,二氧化硫有漂白性 |
D将b试管冷却后,将试管内液体小心倒掉,再向试管内加蒸馏水振荡。 | 溶液变蓝色 | 浓硫酸与铜混合后加热有硫酸铜生成,硫酸铜溶解于水,溶液变蓝色 |
Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
铜是还原剂;浓硫酸有一半是氧化剂、一半表现酸性。
浓硫酸的氧化性是由于分子里的+6价硫引起,氧化性强,可以氧化绝大多数金属(但不能氧化金和铂);稀硫酸的氧化性是由于它电离出的H+引起的。稀硫酸只可氧化金属活动性顺序中氢以前我金属。
所以当金属与浓硫酸作用时,总是+6价硫得电子,而不是氢得电子。即浓硫酸反应时不产生氢气。
把铁片、铝片放入盛有少量浓硫酸的试管中,没有气体生成。
原因:铁、铝在冷的浓硫酸中,表面被氧化生成一层致密的氧化膜,阻止了金属与酸进一步反应。这种作用叫钝化。
③氧化化合物
浓硫酸还可以氧化多种化合物,如-2价硫,+2价铁等,H2SO4(浓)+ H2S= SO2+S↓+ 2H2O
六、硝酸的氧化性
硝酸具有强氧化性,越浓,氧化性越强。HNO3中+5价N的氧化性远大于+1价H的氧化性,所以,硝酸做氧化剂时,一般都是N元素被还原。根据不同条件,得到水同价态的还原产物。如NO2、HNO2、NO、N2O、N2、NH3等。
①氧化金属:除铂、金等少数金属外,绝大多数金属都可以被硝酸氧化。
Cu + 4HNO3(浓)= Cu(NO3)2+2NO2↑+ 2H2O;
3Cu + 8HNO3(稀)=3Cu(NO3)2+2NO↑+ 4H2O
铝、铁在冷的浓硝酸中被钝化。
②氧化非金属
浓HNO3在加热时可将C、S等非金属氧化,如C + 4HNO3(浓)![]() CO2↑+ 4NO2↑+ 2H2O
CO2↑+ 4NO2↑+ 2H2O
③氧化化合物:低价态的硫、+2价铁等物质,都可以被硝酸氧化。如
2HNO3(浓)+ Fe(NO3)2=== Fe(NO3)3+NO2↑+H2O
4HNO3(稀)+ 3Fe(NO3)2=== 3Fe(NO3)3+NO↑+2H2O
三、王水:浓硝酸和浓盐酸的混合物(体积比为1:3),可以氧化铂、金等金属。
浓硫酸与硝酸的比较
浓H2SO4 | 稀HNO3 | 浓HNO3 | |||
强氧化性 | 与金属 | Fe、Al(常温) | 钝化 | NO | 钝化 |
Cu(加热) | SO2(加热) | NO | NO2 | ||
与非金c(加热) | CO2、SO2 | CO2、NO2 | |||
与化合物 | SO2 | NO | NO2 | ||
其他特性 | 脱水性 | 王水 | |||
吸水性 | |||||

- 全部评论(0)
