利用电荷守恒巧解电化学中的离子迁移
时间:2018-01-24 11:09 来源:未知 作者:高衍文 点击: 次 所属专题: 离子交换膜 离子迁移
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
离子交换膜对不同电荷的离子具有选择透过性.阳膜只允许通过阳离子,阻止阴离子通过;阴膜只允许通过阴离子,阻止阳离子通过.在外加直流电场的作用下,水中离子做定向迁移.分清隔膜类型,即分清交换膜属于阳膜、阴膜或质子交换膜中的哪一种,判断允许什么离子通过隔膜.含有隔膜的原电池、电解池中离子的迁移计算是电化学学习的难点,同时也是高考能力题考查的重点,本文从以下几个方面进行剖析.
1 迁移原理
例1 某原电池装置如图1所示,电池总反应为2Ag+Cl2=2AgCl.
(1) 当电路中转移Amol电子时,质子交换膜左侧溶液中约减少______mol离子,质子交换膜右侧溶液c(HCl)______(填“>”“<”“=”) 1mol·L-1(忽略溶液体积变化).
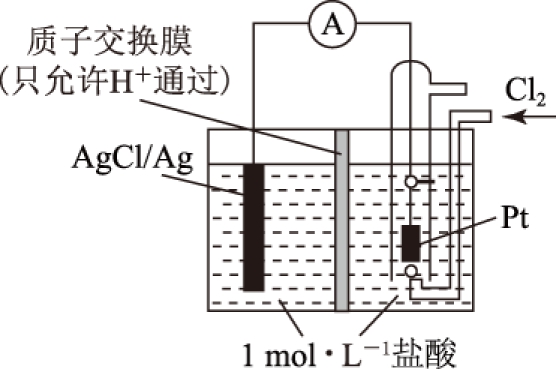
图1
(2) 假设将质子交换膜换成阴离子交换膜,其他条件不变.若有11.2L(标准状况)氯气参与反应,则必有________mol________(填离子符号)由交换膜________侧通过交换膜向________侧迁移.交换膜右侧溶液c(HCl)________(填“>”“<”“=”)1mol·L-1(忽略溶液体积变化).
![]() (1)正极的电极反应式为Cl2+2e-=2Cl-,负极的电极反应式为Ag-e-+Cl-=AgCl,质子交换膜只允许氢离子通过,转移Amol电子,必有AmolCl-生成沉淀,为了维持电荷平衡,交换膜左侧溶液中必有AmolH+向右侧迁移,故交换膜左侧共减少2Amol离子(AmolCl-+AmolH+).交换膜右侧溶液中氯化氢浓度增大.
(1)正极的电极反应式为Cl2+2e-=2Cl-,负极的电极反应式为Ag-e-+Cl-=AgCl,质子交换膜只允许氢离子通过,转移Amol电子,必有AmolCl-生成沉淀,为了维持电荷平衡,交换膜左侧溶液中必有AmolH+向右侧迁移,故交换膜左侧共减少2Amol离子(AmolCl-+AmolH+).交换膜右侧溶液中氯化氢浓度增大.
(2)n(Cl2)=0.5mol,n(Cl-)=1mol,n(e-)=1mol,交换膜右侧溶液中增加了1mol 负电荷(或增加了1mol Cl-),左侧减少了1mol 负电荷(或减少了1mol Cl-).如果将质子交换膜换成阴离子交换膜,只允许阴离子(Cl-)通过交换膜,不允许H+通过.为了维持电荷平衡,必有1mol Cl-从交换膜右侧通过交换膜向左侧迁移,Cl-迁移之后,两侧溶液中盐酸浓度保持不变.
答案 (1) 2A; >. (2) 1;Cl-; 右; 左; =.
2 迁移数目的计算
例2 某电化学装置如图2所示(阴离子交换膜只允许阴离子通过,通常简称阴膜).
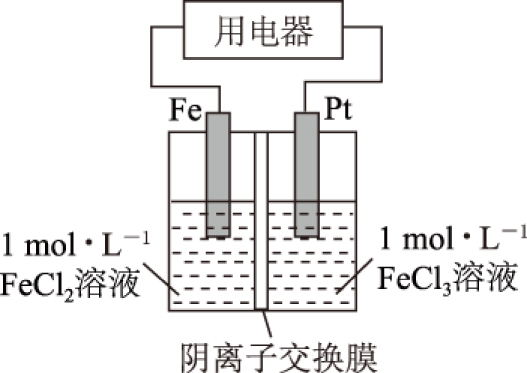
图2
(1) 该装置工作一段时间后,阴离子交换膜左侧增加的离子数目与右侧减少的离子数目之比为______.
(2) 若将氯化铁溶液换成硫酸铜溶液,其他条件不变,工作一段时间,阴离子交换膜左侧增加的离子数目与右侧减少的离子数目之比为______.
![]() (1) 转移电子数目与交换膜两侧离子变化量之比无关.可以采用赋值法计算.若转移2mol 电子,负极的电极反应式为Fe-2e-=Fe2+,正极的电极反应式为2Fe3++2e-=2Fe2+.由电极反应式知,阴膜左侧增加1mol Fe2+;阴膜右侧的2mol Fe3+变成2mol Fe2+,阳离子数没有变化.左侧过剩了2mol 正电荷,右侧减少了2mol 正电荷(可认为过剩了2mol 负电荷).阴离子交换膜只允许阴离子通过,为了维持电荷平衡,必有2mol Cl-由右侧通过交换膜向左侧迁移.故阴离子交换膜左侧增加离子为1mol Fe2+和2mol Cl-,右侧减少离子为2mol Cl-,二者之比为3∶2.
(1) 转移电子数目与交换膜两侧离子变化量之比无关.可以采用赋值法计算.若转移2mol 电子,负极的电极反应式为Fe-2e-=Fe2+,正极的电极反应式为2Fe3++2e-=2Fe2+.由电极反应式知,阴膜左侧增加1mol Fe2+;阴膜右侧的2mol Fe3+变成2mol Fe2+,阳离子数没有变化.左侧过剩了2mol 正电荷,右侧减少了2mol 正电荷(可认为过剩了2mol 负电荷).阴离子交换膜只允许阴离子通过,为了维持电荷平衡,必有2mol Cl-由右侧通过交换膜向左侧迁移.故阴离子交换膜左侧增加离子为1mol Fe2+和2mol Cl-,右侧减少离子为2mol Cl-,二者之比为3∶2.
(2) 氯化铁溶液换成硫酸铜溶液,正极的电极反应式为Cu2++2e-=Cu,假设转移电子为2mol,交换膜左侧增加1mol Fe2+,交换膜右侧有1mol Cu2+变成1mol Cu,左侧过剩了2mol 正电荷,右侧减少了2mol 正电荷(或过剩了2mol 负电荷![]() 从右侧通过交换膜向左侧迁移.因此,左侧增加了1mol Fe2+和
从右侧通过交换膜向左侧迁移.因此,左侧增加了1mol Fe2+和![]() 右侧减少了1mol Cu2+和
右侧减少了1mol Cu2+和![]() 二者之比为1∶1.
二者之比为1∶1.
答案 (1) 3∶2. (2) 1∶1.

- 全部评论(0)
