掌握离子交换膜—轻松拿下高考电化学分数
时间:2023-02-28 08:36 来源:未知 作者:化学自习室 点击: 次 所属专题: 离子交换膜
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
近几年全国卷的高考中,涉及离子交换膜的试题较多,且常考常新。离子交换膜是一种含有离子基团的、对溶液中离子具有选择性透过的高分子膜。根据透过的微粒类型,离子交换膜可以分为多种。其功能是在于选择性通过某些离子和阻断某些离子或隔离某些物质,从而制备、分离或提纯某些物质。
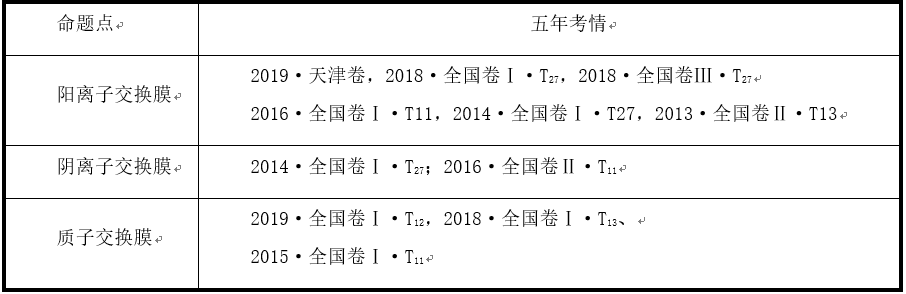
一、离子交换膜类型及应用
离子交换膜的选择依据:离子的定向移动!
二、多室电解池
多室电解池是利用离子交换膜的选择透过性,即允许带某种电荷的离子通过而限制带相反电荷的离子通过,将电解池分为两室、三室、多室等,以达到浓缩、净化、提纯及电化学合成的目的。
1.单膜应用(两室电解池)
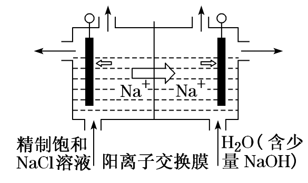
①制备原理:工业上利用如图两室电解装置制备烧碱
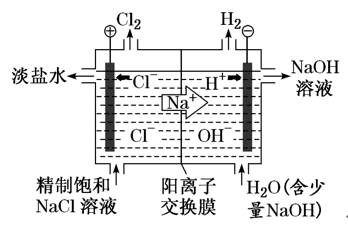
阳极室中电极反应:2Cl--2e-===Cl2↑,阴极室中的电极反应:2H2O+2e-===H2↑+2OH-;
阴极区H+放电,破坏了水的电离平衡,使OH-浓度增大,阳极区Cl-放电,使溶液中的c(Cl-)减小,为保持电荷守恒,阳极室中的Na+通过阳离子交换膜与阴极室中生成的OH-结合,得到浓的NaOH溶液。利用这种方法制备物质,纯度较高,基本没有杂质。
②阳离子交换膜的作用
它只允许Na+通过,而阻止阴离子(Cl-)和气体(Cl2)通过。这样既防止了两极产生的H2和Cl2混合爆炸,又避免了Cl2和阴极产生的NaOH反应生成NaClO而影响烧碱的质量。
2.双膜(三室电解池)
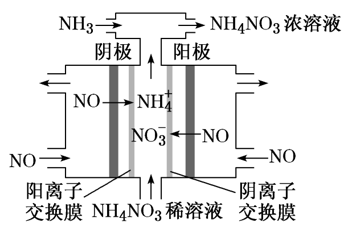
利用三室电解装置制备NH4NO3,其工作原理如图所示。

3.多室电解池
利用“四室电渗析法”制备H3PO2(次磷酸),其工作原理如图所示。
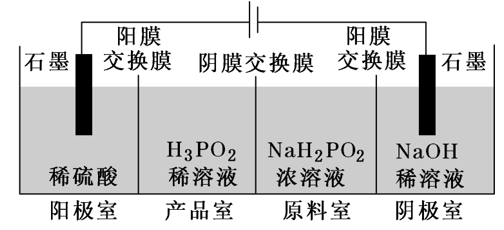
电解稀硫酸的阳极反应:2H2O-4e-===O2↑+4H+,产生的H+通过阳离子交换膜进入产品室,原料室中的H2PO穿过阴离子交换膜进入产品室,与H+结合生成弱电解质H3PO2;电解NaOH稀溶液的阴极反应:4H2O+4e-===2H2↑+4OH-,原料室中的Na+通过阳离子交换膜进入阴极室。
三、实际应用
【应用一】用于物质的分离和提纯
质子交换膜—身轻个小穿空隙,漂洋过海来看你
【例题1】.如图是电化学催化还原二氧化碳制备一氧化碳的装置示意图,质子交换膜将电解池分隔为阴极室和阳极室。下列说法中正确的是( )
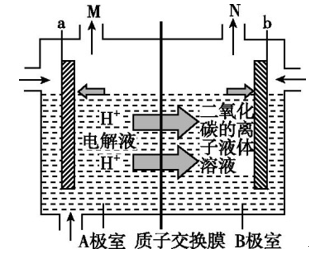
A.a是阴极
B.B极室的反应是CO2+2e-+2H+===CO+H2O
C.一段时间后,A极室中溶液的pH增大
D.电子由B极室流向A极室
【答案】B
【备考方略】含离子交换膜电化学装置题的解题步骤

【练习】.生产硝酸钙的工业废水常含有NH4NO3,可用电解法净化。其工作原理如图所示。下列有关说法正确的是
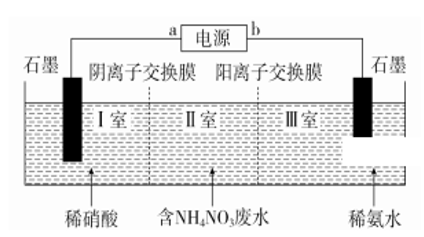
A.a极为电源负极,b极为电源正极
B.装置工作时电子由b极流出,经导线、电解槽流入a极
C.Ⅰ室能得到副产品浓硝酸Ⅲ室能得到副产品浓氨水
D.阴极的电极反应式为2NO3-+12H++10e-=N2↑+6H2O
【答案】C
【应用二】隔离某些离子,防止副反应
【例题】
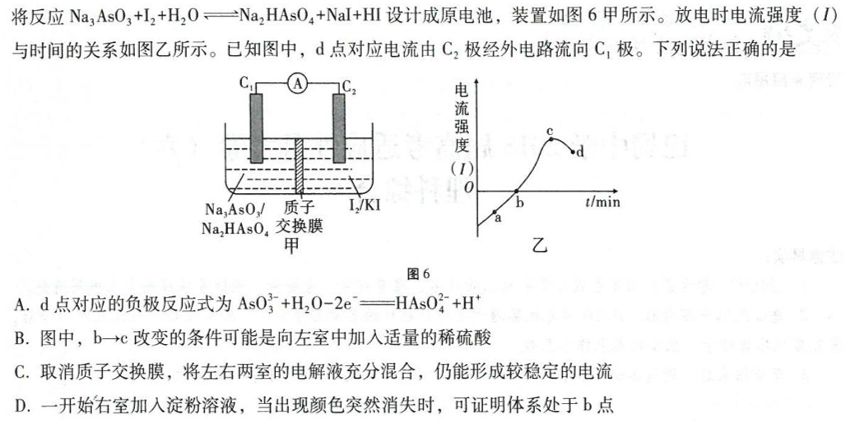
【答案】A
【练习1】.(2018·浙江11月选考)最近,科学家研发了“全氢电池”,其工作原理如图所示。下列说法不正确的是( )
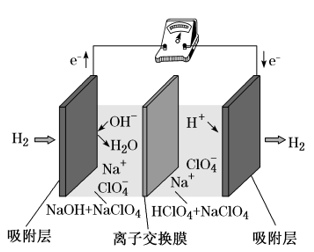
A.右边吸附层中发生了还原反应
B.负极的电极反应是H2-2e-+2OH-===2H2O
C.电池的总反应是2H2+O2===2H2O
D.电解质溶液中Na+向右移动,ClO4-向左移动
【答案】C
【应用三】利用离子交换膜制备纯净产品
类型(一) 判断离子的迁移方向
阳离子交换膜—如果不相见,便可不相恋
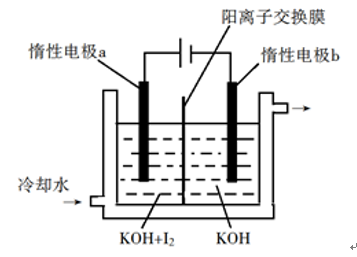
【例题1】.[2018新课标II节选](1)KIO3也可采用“电解法”制备,装置如图所示。
①写出电解时阴极的电极反应式 。
②电解过程中通过阳离子交换膜的离子主要为_____,其迁移方向是__________。
③与“电解法”相比,“KClO3氧化法”的主要不足之处有 _____ (写出 一点)。
一点)。
(2)[2018新课标I节选]制备Na2S2O5也可采用三室膜电解技术,装置如图所示,其中SO2碱吸收液中含有NaHSO3和Na2SO3。阳极的电极反应式为_____________。电解后,__________室的NaHSO3浓度增加。将该室溶液进行结晶脱水,可得到Na2S2O5。
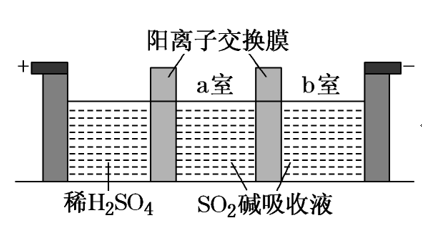
【答案】(1).2H2O+2e-===2OH-+H2↑ K+ a到b 产生Cl2易污染环境等
(2)2H2O-4e-=4H++O2↑ a
【解析】(2)阳极发生氧化反应,电极反应式为2H2O-4e-=4H++O2↑,H+通过阳离子交换膜由阳极向a室移动,得到NaHSO3,故a室NaHSO3增多。
多膜电解—莫说没有出路,终将各有归宿
【例题2】.H3PO2可用电渗析法制备,“四室电渗析法”工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):
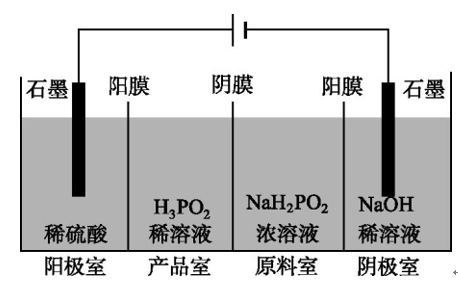
①写出阳极的电极反应式__________:。
②分析产品室可得到H3PO2的原因:__________。
③早期采用“三室电渗析法”制备H3PO2:将“四室电渗析法”中阳极室的稀硫酸用H3PO2稀溶液代替,并撤去阳极室与产品室之间的阳膜,从而合并了阳极室与产品室。其缺点是产品中混有杂质,该杂质产生的原因是 。
【答案】①2H2O-4e-===O2↑+4H+
②阳极室的H+穿过阳膜扩散至产品室,原料室的H2PO2-穿过阴膜扩散至产品室,二者反应生成H3PO2
③PO43-H2PO4-或H3PO2被氧化
【详解】
(1)由于阳极中阴离子为SO42-、OH-和H2PO2-,其中放电能力最强的是OH-,则阳极发生的电极反应为:2H2O-4e-====O2↑+4H+或者4OH--4e-===O2↑+2H2O;
(2)产品室可得到H2PO3的原因是因为:阳极室的生成的H+穿过阳膜扩散至产品室,而阴极发生的是2H2O+2e-====H2↑+2OH-,阴离子浓度增大,原料室中Na+通过阳离子交换膜进入阴极室,中和电性,原料室中的H2PO2-穿过阴膜扩散至产品室,二者反应生成H3PO2;
(3)早期采用“三室电渗析法”制备H3PO2,将“四室电渗析法”中阳极室的稀硫酸用H3PO2稀溶液代替,并撤去阳极室与产品室之间的阳膜,从而合并了阳极室与产品室,其缺点是阳极产生的氧气会把H2PO2-或H3PO2氧化成PO43-,产品中混有PO43-。
总结
解释电化学装置中,物质在某区域产生的原因,答题要点一般可考虑以下四点:
①说明某区域的电极反应(该区域没有电极反应,则不必说明电极反应);
②说明电极反应对某平衡的影响(不存在平衡体系时,则不必考虑平衡移动);
③说明离子通过离子交换膜的移动情况;
④说明各种物质的生成情况。
【备考方略】有“膜”条件下离子定向移动方向的判断方法

【练习1】.(2019·泸州一诊)氢碘酸(HI)可用“四室电渗析法”制备,其工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过)。下列叙述错误的是( )
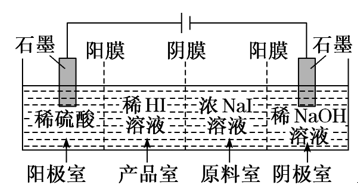
A.通电后,阴极室溶液的pH增大
B.阳极电极反应式是2H2O-4e-===4H++O2↑
C.得到1 mol 产品HI,阳极室溶液质量减少8 g
D.通电过程中,NaI的浓度逐渐减小
【答案】C
类型(二) 判断离子交换膜的类型
多膜电解—莫说没有出路,终将各有归宿
【例题3】.四室式电渗析法制备盐酸和NaOH的装置如图所示。a、b、c为阴、阳离子交换膜。已知:阴离子交换膜只允许阴离子透过,阳离子交换膜只允许阳离子透过。下列叙述正确的是( )
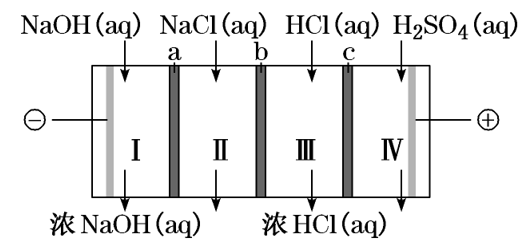
A.b、c分别依次为阳离子交换膜、阴离子交换膜
B.通电后Ⅲ室中的Cl-透过c迁移至阳极区
C.Ⅰ、Ⅱ、Ⅲ、Ⅳ四室中的溶液的pH均升高
D.电池总反应为4NaCl+6H2O===4NaOH+4HCl+2H2↑+O2↑
【答案】D
【备考方略】离子交换膜类型的判断方法
根据电解质溶液呈中性的原则,判断膜的类型,判断时首先写出阴、阳两极上的电极反应,依据电极反应式确定该电极附近哪种离子剩余,因该电极附近溶液呈电中性,从而判断出离子移动的方向,进而确定离子交换膜的类型。
离子交换膜的功能在于选择性地通过某些离子,目的是平衡整个溶液的离子浓度或电荷,利用离子交换膜的这一功能可用来制备物质,解题时应先分析出应制备或提纯的物质,后确定装置的正、负极,根据离子交换膜的功能判断特定离子的移动方向,进而逐一解答。
【练习】H3BO3可以通过电解NaB(OH)4溶液的方法制备,其工作原理如图,下列叙述错误的是( )
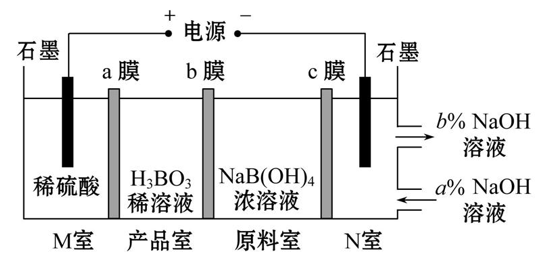
A.M室发生的电极反应为2H2O-4e-====O2↑+4H+
B.N室中:a%<b%
C.b膜为阴离子膜,产品室发生反应的化学原理为强酸制弱酸
D.理论上每生成1 mol 产品,阴极室可生成标准状况下5.6 L 气体
【答案】D
【应用四】离子交换膜的相关计算
跨膜转移的电荷数=电极反应转移的电子数
【例题1】【海南省海南中学2018届高三第五次月考】(双选)一种高能纳米级Fe3S4和镁的二次电池,其工作原理为:Fe3S4+4Mg 3Fe+4MgS,装置如图所示。下列说法不正确的是( )
3Fe+4MgS,装置如图所示。下列说法不正确的是( )
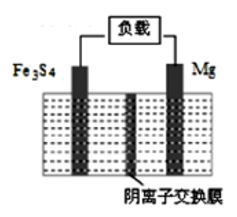
A. 放电时,电路中转移0.5mol 电子则阴离子交换膜上移动0.5mol S2-
B. 放电时,正极的电极反应式为Fe3S4+8e-=3Fe+4s2-
C. 充电时,阴极的电极反应式为MgS+2e-=Mg+S2-
D. 充电时,S2-从阴离子交换膜左侧向右侧迁移
【答案】AD
【分析】根据电池反应式知,放电时为原电池反应,Mg失电子发生氧化反应,则Mg是负极,电极反应式为Mg-2e-=Mg2+,Fe3S4为正极,正极反应式为Fe3S4+8e-=3Fe+4S2-
【例题2】.已知:2CrO42-(黄色)+2H+===Cr2O72-(橙色)+H2O。以铬酸钾(右室起始加入0.4 mol K2CrO4)为原料,电化学法制备重铬酸钾的实验装置示意图如图所示,下列说法正确的是 ( )
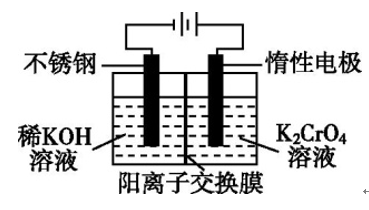
A.在阳极室,通电后溶液逐渐由橙色变为黄色
B.电路中有0.2 mol 电子通过时,阳极与阴极溶液减少的质量差为1.4 g
C.若测得右室中K与Cr的物质的量之比为3∶2,则此过程电路中共转移电子数为0.1NA
D.若测定阳极液中K与Cr的物质的量之比为d,则此时铬酸钾的转化率为2-d

【练习】【节选(3)】Ⅲ中离子隔膜电解池的装置如图。
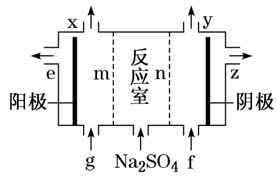
①A的化学式是_________,A在_________口产生。
②m为_______(填“阴”或“阳”)离子交换膜。
③结合化学用语和文字说明解释NaOH产生的原因:______________________________。
(4)目前已开发出用电解法制取ClO2的新工艺。
①图中用石墨作电极,在一定条件下电解饱和食盐水制取ClO2。则阳极产生ClO2的电极反应式为____________。
②电解一段时间,当阴极产生的气体体积为112 mL(标准状况)时,停止电解。通过阳离子交换膜的阳离子的物质的量为________mol。
【答案】(3)①H2SO4 E ②阴 ③阴极反应为2H2O+2e-===H2↑+2OH-,反应室中的Na+透过阳离子交换膜进入阴极室,和阴极区产生的OH-生成NaOH
(4)①Cl--5e-+2H2O===ClO2↑+4H+ ②0.01
【总结】:
1.掌握电化学中的离子移动方向,结合离子交换膜类型轻松判断离子移动及电极方程式书写。
2.离子交换膜作用:制备纯净产品及分离提纯某些物质

- 全部评论(0)
