冰的晶体特点介绍
时间:2018-05-21 16:14 来源:未知 作者:化学自习室 点击: 次 所属专题: 冰的结构
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
在晶体结构中,水的晶体是常见的。水的晶体不是“水晶”,水晶(Quartz Crystal)是硅酸盐的晶体。是一种无色透明的大型石英结晶体矿物。它的主要化学成份是二氧化硅,化学式为SiO2。
先看水分子形成冰的过程。温度高时,水分子动能大而无法彼此牢固产生氢键,分子间以尽可能小的距离进行杂乱无章的排列。
温度降低后(低于4度),越来越多的分子动能不足以打破产生的氢键,而氢键有一定键长,所以4度以后固定的氢键越来越多.
当0度时所有的水分子都被固定在一定区域内,氢键使水分子彼此保持一段距离。
在水结成冰时,水分子的运动不能破坏氢键,氢键起主要作用,它把水分子结起来形成有规则的空间结构,在一个晶格中,四个氢原子在正四面体的顶点上,一个氧原子位于四面体的中心。这样,使分子间的空隙变大且保持一定,因此水结成冰时体积变大。而在液态中,水分子运动既能破坏水分子之间的氢键束缚,而又不使分子作剧烈运动导致分子间频繁碰撞,各分子间可发生相对滑动而相互交错,这样就会互相填补空隙因而体积变小。
冰(H2O)的固相结构有20余种,这里介绍的是最为常见的冰(Ih)的晶体结构,可能多数人不甚清楚。有彩色的晶体结构图片。罗马字母之后的h表示六方晶系,c表示等轴晶系。
冰(Ih)的晶体结构
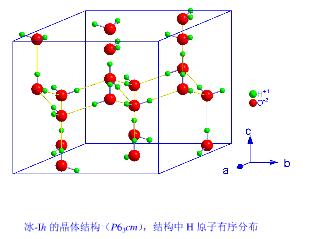
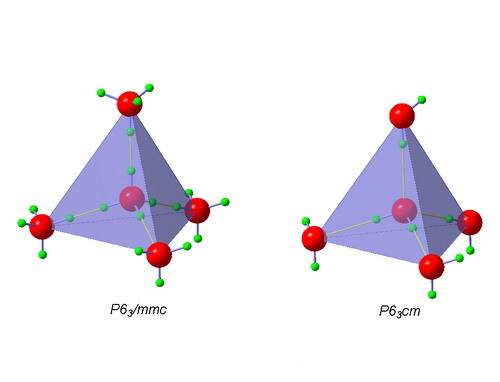
氧原子周围,氢的无序分布(左图)和有序分布(右图)
(责任编辑:化学自习室)

说点什么吧
- 全部评论(0)
还没有评论,快来抢沙发吧!
