金属锂在金属活动顺序表中的特殊性分析
时间:2019-01-03 10:58 来源:未知 作者:化学自习室 点击: 次 所属专题: 锂 金属活动顺序表
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
金属活动性顺序表有何用?
1.判断常见金属的金属性
2.前面的金属可以把后面的金属从他们的可溶性盐中置换出来(除K、Ca、Na)
3.金属性越强的金属与酸或水反应就越剧烈
......

你见过这样的金属活动性顺序表吗?

您发现了什么? 特别刺眼是什么? 锂!锂!锂!
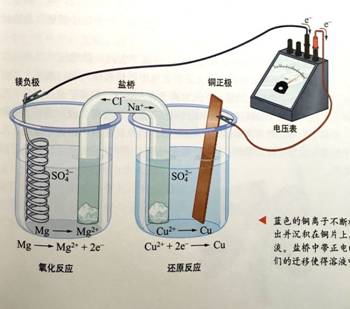
镁铜组成原电池,镁为负极是毫无疑问的——这也是我们经常用来判断两种金属活泼性常用方法。
难道锂和镁组成标准的原电池锂是负极吗?
没有错,您的判断正确
金属活动性最强的确是锂。金属活动性是个热力学标准,由标态下的电极电势决定。
那问题来了
活泼性越强的金属与酸反应越快吗?
值得注意的是金属与酸反应的快慢是动力学范畴!
也就是说,排在前面的金属与酸或水反应的速率不一定快!
这是真的吗
不信?先来看看视频!实验证实是活泼金属钙与水的反应情况、比较金属钠,显然慢得多,况且钙与水的接触面积大呢。
[实验]把质量、形状相同的金属钙分别投放到盛有100mLH2O和1M的硫酸溶液的两只烧杯中,观察实验现象。
实验现象:钙与水反应并没有想象中那么剧烈,比较钠与水的反应,上述反应却相对平缓,其中钙与稀硫酸反应时,反应速率更慢,随着反应的进行,溶液都会出现突然变浑浊的现象。
查阅φθ(Li+/Li) =-3.042V,若把金属Li排到金属活动性顺序表中,自然就排在最前面了。
当之无愧!
为什么锂的电极电位很负的原因比较复杂,据说是因为锂离子形成水合锂离子后会放出大量的热,即是一个焓减非常明显的过程。
鉴于中学阶段的化学教材中只是对一些常见的金属进行排序,兼顾金属活动性与金属与酸反应的剧烈程度的一致性,就不把金属锂放在顺序表中(以免造成不必要的麻烦)。
(责任编辑:化学自习室)

说点什么吧
- 全部评论(0)
还没有评论,快来抢沙发吧!
