硝酸与金属反应有哪些规律?
时间:2019-11-12 09:52 来源:未知 作者:化学自习室 点击: 次 所属专题: 硝酸与金属
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
除了金、铂以及一些稀有金属,一般的金属都能与HNO3起 反应。金属被氧化成其硝酸盐,硝酸的还原产物却有好几种。这 是由于氮的氧化物在化学元素中形式最多,与之相应的化合物如下:
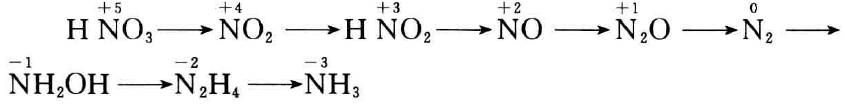
从HNO3 + 4〜-3价产物的标 准电极电位(此处未列出)都较高这 一点来看,生成各种产物的可能性似 乎都很大。不过,由于反应速度很慢 等原因,有些产物实际上不会生成。
跟金属反应时,浓HNO3生成NO2,稀HNO3生成NO,这是中学教材所 要求学生了解的。如果较稀的HNO3 跟活泼金属反应,产物还可以是 N2O、N2、NH3 (实际产物是NH4NO3)。生成什么产物,跟金属的活泼性有关,也跟HNO3的 浓度有关。

上图是用铁还原不同浓度的HNO3时各种产物的相对含量的图像,在HNO3较稀时(密度1.05 g• cm-3、物质的量 浓度为1.5 mol·L-1),主要产物是NH3,随着HNO3浓度增大, 生成NH3的量逐渐减少,而NO的相对含量逐渐增加。当硝酸密 度为1. 25 g • cm-3 (约8 mol • L-1) 时,生成物中已经没有NH3 了,NO成为主要产物,还有少量NO2和微量N2O、N2生成。当 HNO3 密度增至 1. 35 g • cm-3 (12 mol• L-1)时,NO2 成为主要 产物。
在中学里强调指出“硝酸氧化性强,因此跟金属反应不会生 成氢气”。然而,极稀的HNO3跟金属Mg反应时,能生成氢气。 这是因为Mg很活泼,它跟热水或NH4Cl溶液也能反应,置换出 氢气。极稀的HNO3溶液中,NO3-离子浓度很小,HNO3的氧化 能力已大为减弱,可小于氢离子的氧化能力,因此置换出氢气是可以理解的。
(责任编辑:化学自习室)

说点什么吧
- 全部评论(0)
还没有评论,快来抢沙发吧!
