浓度化学平衡常数与分压平衡常数关系及应用
时间:2019-12-25 11:15 来源:未知 作者:化学自习室 点击: 次 所属专题: 化学平衡常数 分压平衡常数
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
《无机化学》化学平衡一章告诉我们:对于可逆反应aA + b B dD + eE在一定温度下达到平衡时,反应物、生成物之间存在如下关系
dD + eE在一定温度下达到平衡时,反应物、生成物之间存在如下关系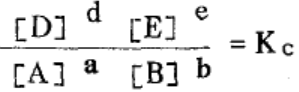
则Kc被称为平衡常数,它是用平衡浓度来量度的。对于气相反应,我们还可以用平衡分压Kp,来表示对于气相反应aA(g) +bB(g) dD(g) +eE(g)而言
dD(g) +eE(g)而言
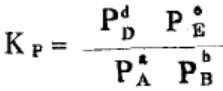
通过克拉伯龙方程PV=nRT,我们可以导出Kp与K的关系Kp=Kc(RT)△n (Δn=d+e-a-b)
除了可用这两种方法表示平衡常数外,再向大家介绍另一种表示法,即用各物质在平衡时的物质的量的分数来表示。 对于气相反应'aA(g)+bB(g) dD(g)+eE(g),在T,P一定时,反应物、生成物满足,
dD(g)+eE(g),在T,P一定时,反应物、生成物满足,
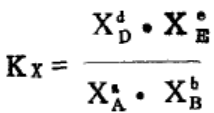
(其中XA表示A的物质的量分数,依次类推)。则Kx称为用平衡物质的量数表示的平衡常数,我们也可以导出Kx与Kp的关系。
设反应达到时平衡,体系的物质的量是n,总压力是P,各物质的量分别是n(A),n(B),n(D), n(E),则据分压定律可得:
![]()
依次类推,所以有:
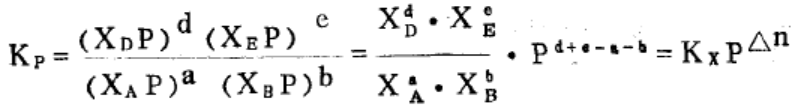
(Δn=d+e-a-b)
注意,该式仅适用于气相反应的情况,且压强的单位是atm。
惰性气体对平衡(气相)休系的影响
先看问题:在800K, latm下进行丁烯脱氢反应:C4H8(g) C4H6(g) +H2(g),其平衡常数为Kp=2.15 × 10-2
C4H6(g) +H2(g),其平衡常数为Kp=2.15 × 10-2
①以丁烯为原料气;②以丁烯和水蒸气的混合物为原料(水蒸气为惰性成分)。
求上述两种情况下丁烯的转化率,设②中混合气体中丁烯与H2O的摩尔比是1:10
解①设丁烯原料气的摩尔数是lmol,反应掉 x mol,则
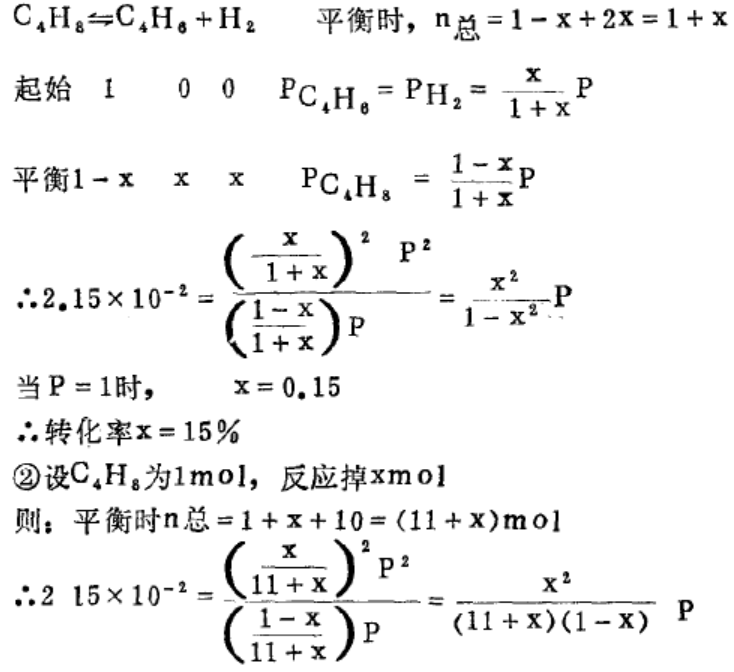
当P=1时则x = 0. 49 .’.x=49%
转化率由15%提高到49%,说明可使平衡向右移动。
从以上例题可证明:惰性组分气体对平衡有影响,其影响与反应条件有关:
①当反应物是恒温恒压下进行的,且△n≠0。时,平衡体系中引入情性气体组分降低反应物,生成物的分压,使平衡向体系增大的方向移动(如本题)。
②在恒温恒容下,引入惰性组分气体会增大体系压强,但由于体系中各反应物及生成物的分压维持不变,所以平衡不移动。

- 全部评论(0)
(673053115) 评论 href="/plus/view.php?aid=17738">浓度化学平衡常数与:打赏。能转成复制文档吗
