等电子体及其应用
时间:2020-01-01 14:39 来源:未知 作者:化学自习室 点击: 次 所属专题: 等电子体
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、 “等电子体”推导的一般方法
等电子体概念的核心内容是结构微粒的“两个相等”(原子数相等和价电子总数相等)。现将一些等电子体整理出来(见下表)。
等电子体类型 | 等电子体 |
2原子10价电子 | N2、CO、CN-、NO+、C22-、O22+ |
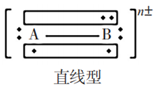
3原子16价电子 | CO2、CS2、N2O、SCN-、NO2+、N3- |
3原子18价电子 | SO2、O3、NO |
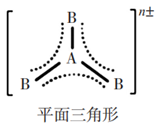
4原子24价电子 | SO3、BF3、NO3-、CO32- |
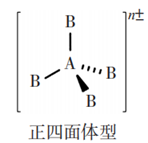
5原子32价电子 | SiF4、CCl4、PO43-、SO42-、ClO4-, |
当然,直接背诵的方法虽然直接,但是不利于学生从根本上解决问题,还是应该把最基本的方法教给学生,让学生能够在现有的知识范围内,直接对等电子体进行快速准确的推导。只要让学生将常见短周期非金属元素及价电子数列出(见下表),然后在明确原子总数的基础上,对价电子总数进行简单的估算和调整,一般都能找到合适的等电子体。
价电子数 | 3 | 4 | 5 | 6 | 7 |
第二周期元素 | B | C | N | O | F |
第三周期元素 | Si | P | S | Cl |
以寻找CO2的等电子体为例,首先明确CO2的等电子体是3原子16价电子的分子或离子。
方法一:同族元素等量代换CO2![]() CS2(或COS)
CS2(或COS)
方法二:根据上表估算湊出分子CO2![]() N2O
N2O
方法三:观察上表估算并调整价电子数湊出离子
CO2![]() N3-
N3-
CO2![]() NO2+
NO2+
CO2![]() SCN-(或OCN-)
SCN-(或OCN-)
在利用相邻元素替代推导某些离子的等电子体时核电荷数变化关联离子电荷数的变化也可成为推导的思路。比如SO2的等电子体推导。
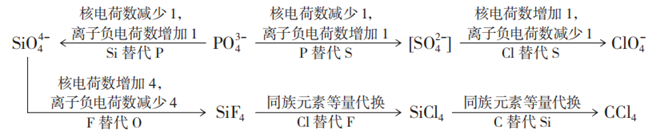
二、 “等电子原理”的应用
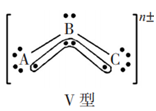
互为等电子体的分子或离子具有相同的结构特征,这里的“结构特征”包括化学键类型和分子或离子的空间结构(键角不一定相等)。如互为等电子体的SO2、O3、NO2-,其中心原子S、O、N以sp2杂化道分别与另2个原子形成2个σ键,另有一套大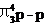 键,是V型极性分子,其中SO2的结构可表示为
键,是V型极性分子,其中SO2的结构可表示为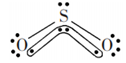 ,键角约119.5°。下表列出了某些等电子体的结构特征。
,键角约119.5°。下表列出了某些等电子体的结构特征。
全国 | 实例 | 成键特点 | 结构 |
2原子10价电子 | N2、CO、CN-、NO+、C22-、O22- | 1个σ键2个π键 |
|
3原子16价电子 | CO2、CS2、N2O、SCN-、NO2+、N3- | 中心原子以sp杂化轨道形成2个σ键。另有两套 |
|
3原子18价电子 | SO2、O3、NO2- | 中心原子以sp2杂化轨道形成2个σ键,另有一套 |
|
4原子24价电子 | SO3、BF3、NO3-、CO32- | 中心原子以sp2杂化轨道形成3个σ键。另有一套 |
|
5原子32价电子 | SiF4、CCl4、PO43-、SO42-、ClO4- | 中心原子以sp3杂化轨道形成4个σ键 |
|
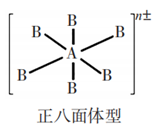
7原子48价电子 | SF6、AlF63-、SiF62-、PF6- | 中心原子以sp3d2杂化道形成6个σ键 |
|
在高中阶段,一般是要求通过已知的典型分子或离子的结构特征,利用等电子原理推测所不熟悉的分子或离子的结构。
等电子体结构特征上的相似性必然带来某些性质的相似性。如互为等电子体的CO、CN-、NO+都可以作为配位体形成配合物,那么CO、NO和KCN的毒性便有了合理的解释:在配位反应中,NO可以将1个电子提供给金属M形成NO+(M+NO→NO++M-),CO、NO(NO+)和CN-都因其与人体血红蛋白中的Fe2+的强配位能力而使人中毒。
等电子原理作为一种简单易用的经验规律,给学习化学带来一些方便,这样的便利更多的是对原子的键合方式和空间构型的判断,但等电子原理并不是万能的,是有其局限性和使用范围的,等电子原理在使用中的无限推广可能会导致错误。如被称为无机苯的环硼氮六烷(B3N3H6)与苯(C6H6)互为等电子体(如下图所示)。然无机苯B、N都是sp2杂化,形成与苯相似的平面六元环结构,但二者却有着本质的不同
无机苯中B、N原子间的双键实质是一种定域的配位键,分子中存在真正的“单双键交替”结构,这与苯分子中的大键完全不同,无机不具有芳香性,因此无机苯的化学性质与苯也有明显的差异。
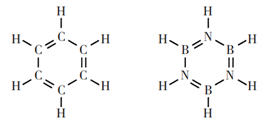
苯和“无机苯”的结构
1. 与CO互为等电子体的分子和离子分别为______和______。
【答案】 N2 C22- 或 CN-
2. 与N3-互为等电子体的一种分子为:_______
【答案】 CO2
3. PCl5中P-Cl键长有198pm和206pm两种。PCl5是非极性分子,可作为导电熔体,其原理为PCl5电离为一个阴离子和一个阳离子,其中阴离子为正八面体,阳离子为正四面体,写出一种阳离子的等电子体的化学式____,PCl5的立体构型为____;
【答案】 SiCl4或SiF4或SO42-或![]() 等合理答案均可
等合理答案均可
4.配合物[Cu(CH3C![]() N)4]BF4中,BF4-的空间构型为___________。写出与BF4-互为等电子体的一种分子和一种离子的化学式:___________、___________。
N)4]BF4中,BF4-的空间构型为___________。写出与BF4-互为等电子体的一种分子和一种离子的化学式:___________、___________。
【答案】 CCl4 SO42-
5.[H2F]+[SbF6]-(氟锑酸)是一种超强酸,存在[H2F]+,与[H2F]+具有相同空间构型和键合形式的分子和阴离子分别是______(各举一例)。
【答案】 H2O、NH2-
6. 电石的主要成分是__________(写化学式),其中阴离子与CN-是等电子体,写出CN-的电子式:__________。
【答案】CaC2;![]() ;
;
7. 根据价层电子对互斥理论,预测ClO![]() 的空间构型为___________形,写出一个ClO
的空间构型为___________形,写出一个ClO![]() 的等电子体的化学符号___________.
的等电子体的化学符号___________.
【答案】三角锥 SO![]()
8. 写出一种与铁氰化钾中配体互为等电子体的极性分子的化学式_____。
【答案】 CO
9. Na3AsO3中阴离子与其互为等电子体的分子:_____________(填化学式)。
【答案】 PCl3、PbR3、NF3、NCl3等(答一种即可)
10. 与NO2+互为等电子体的微粒有_____(写出一种)。
【答案】SCN-、CO2、CS2、N3-等中的任一种
11. 根据等电子原理,AlO2-的空间构型为_____。
【答案】直线型
12.HCN分子的结构式为___________,写出一种与CN-互为等电子体的阴离子:___________。
【答案】![]() C22-
C22-
13.写出与NH4+互为等电子体的一种分子和一种离子的化学式______、_______。
【答案】 CH4、SiH4、GeH4 BH4-、AlH4-
14. 根据价层电子对互斥理论,预测ClO3-的空间构型为___________形,写出一个ClO3-的等电子体的化学符号_________。
【答案】 三角锥 SO32-
15.与H2O分子互为等电子体的阴离子为________________。
【答案】(4)NH2-
16.写出[BH4]-的两种等电子体_____________________。
【答案】 CH4 、NH4+
17. 写出与N3-属于等电子体的一种分子__________(填分子式)。
【答案】 CO2或N2O
18. 食品添加剂NaNO2中NO2-中心原子的杂化类型是_____,与NO2-互为等电子体的分子的化学式为___________。(写1种)。
【答案】 SO2、O3
19.与PO3-互为等电子体的化合物分子的化学式为___________。
【答案】 SO3

- 全部评论(0)