原子轨道杂化类型判断的几种方法
时间:2020-01-01 11:24 来源:未知 作者:化学自习室 点击: 次 所属专题: 杂化类型判断
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
1.依据微粒的空间构型
杂化轨道是为了解释多原子分子或复杂离子的空间构型而提出的,因而根据分子的空间构型可以逆推出中心原子的杂化类型,![]() 。中学阶段主要涉及sp类型的杂化,其杂化方式及对应的空间构型、键角如下:
。中学阶段主要涉及sp类型的杂化,其杂化方式及对应的空间构型、键角如下:
杂化轨道类型 | 杂化轨道空间构型 | 键角 |
sp | 直线形 | 180° |
sp2 | 平面三角形 | 120° |
sp3 | 正四面体 | 109.5° |
由此可根据中学阶段中,常见的一些简单分子或复杂离子的结构特点便可推出杂化类型,如CO2为直线形分子、键角为180°,故推断出碳原子的杂化轨道类型为sp;C2H4、C6H6为平面形分子、键角为120°,故推断出碳原子的杂化轨道类型为sp2;CH4、CCl4为正四面体形、键角109.5°,故推断其碳原子的杂化轨道类型为sp3;NH4+为正四面体型、键角109.5°,故推断其氮原子的杂化轨道类型为sp3。
由此还可以扩展到以共价键形成的晶体或特殊结构单元。如金刚石中的碳原子、晶体硅和石英中的硅原子,都是以正四面体形式与周围4个原子形成共价键的,故碳、硅原子采用sp3杂化;石墨的二维结构平面内,每个碳原子与其他三个碳原子结合形成平面六元环层,键角为120°,碳原子采用sp2杂化。
【例1】(1)(2018·全国卷Ⅱ·改编)固体三氧化硫中存在如图(A)所示的三聚分子,该分子中原子的杂化轨道类型为
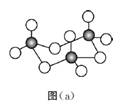
(2)(2016·全国卷·改编)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为,微粒之间存在的作用力是
【答案】(1)sp3(2)sp3共价键
2.运用价层电子对互斥理论
价层电子对互斥理论(VSePr)是为判断中心原子的杂化轨道类型而提出的,并且在预测、解释分子的空间构型方面发挥极强的指导作用。
![]() 。价层电子对互斥理论认为,ABm型分子或复杂离子中,中心原子A的价电子对几何分布(空间构型)与其原子杂化轨道类型对应关系如表(价电子对数大于4在高中阶段不做要求)。
。价层电子对互斥理论认为,ABm型分子或复杂离子中,中心原子A的价电子对几何分布(空间构型)与其原子杂化轨道类型对应关系如表(价电子对数大于4在高中阶段不做要求)。
中心原子价 电子对数 | 价电子对 几何分布 | 中心原子杂化 轨道类型 |
2 | 直线形 | sp |
3 | 平面三角形 | sp |
4 | 正四面体 | sp |
中心原子的价电子对数计算有两种方法:
第1种:价电子对数(n)=[中心原子(A)的价电子数+配位原子(B)提供的价电子数×m]÷2,当n出现奇数时则按照“四舍五入”处理。中心原子(A)为主族元素时,其价电子数=最外层电子数。配位原子(B)为卤族、氢原子时则仅提供1个价电子。为氧族元素原子时则按不提供电子;在计算复杂离子价电子对数时,还应加上负离子的电荷数或减去正离子的电荷数。
第2种:价电子对数(n)=δ键数+中心原子上的孤电子对数。δ键数就是配位原子数m,孤电子对数=[中心原子的价电子数-m个配位原子(B)最多能接受的电子数]÷2。若B为氢时则接受电子数为1,若为其他原子时则接受电子数为(8-该原子的价电子数)。
注意:中心原子的价电子对构型与其对应的分子或复杂离子的空间构型不是同一个概念,价电子对构型中的轨道由成键电子对与孤对电子共同占有,而分子或复杂离子的空间构型则是所有成键原子之间构成的形状,只有孤电子对数为0时,二者的构型才完全相同。
【例2】(1)(2018·全国卷Ⅰ)LiAlH4是有机合成中常用的还原剂,LiAlH4中的阴离子空间构型是中心原子的杂化形式为
(2)(2018·全国卷Ⅱ)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是,气态三氧化硫以单分子形式存在,其分子的立体构型为
(3)(2018·全国卷Ⅲ)《中华本草》等中医典籍中,记载了炉甘石(ZnCO3)入药,可用于治疗皮肤炎症或表面创伤。ZnCO3中,阴离子空间构型为C原子的杂化形式为
(4)(2017·全国卷Ⅱ)X射线衍射测定等发现,I3AsF6中存在I3+。I3+的几何构型为 ,中心原子的杂化形式为
【答案】(1)正四面体sp3(2)H2S平面三角形(3)平面三角形sp3(4)V形 sp3
3.根据中心原子成键类型
由于中学阶段仅涉及sp类型的杂化,故根据中心原子周围π键数有没有形成双键或三键即可判断杂化问题,其思维模型为![]() 。中心原子周围若有2个π键,即用去了2个p轨道,其杂化为sp杂化;若有1个π键,即用去了1个p轨道,其杂化为sp2杂化;若全部是单键(即键),则为sp3杂化。由此可知,只要能写出分子或复杂离子的结构式,即可判断出中心原子的杂化类型。
。中心原子周围若有2个π键,即用去了2个p轨道,其杂化为sp杂化;若有1个π键,即用去了1个p轨道,其杂化为sp2杂化;若全部是单键(即键),则为sp3杂化。由此可知,只要能写出分子或复杂离子的结构式,即可判断出中心原子的杂化类型。
【例3】(1)(2017·全国卷Ⅱ)经X射线衍射测得化合物R的晶体结构,其局部结构如图(B)所示从结构角度分析,R中两种阳离子的相同之处为,不同之处为(填标号)
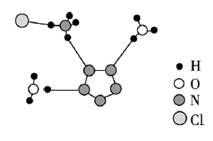
A.中心原子的杂化轨道类型
B.中心原子的价层电子对数
C.立体结构
D.共价键类型
(2)(2017·全国卷Ⅲ)CO2和CH3OH分子中C原子的杂化形式分别为 和 (sp2,sp3)
(3)(2016·全国卷Ⅱ)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是正四面体型
②氨是(填“极性”或“非极性”)分子,中心原子的轨道杂化类型为 (sp3)
4.根据等电子原理
等电子体是指价电子总数和原子总数相同的分子、离子或基团,其电子总数不一定相等。等电子原理是指等电子体具有相同的结构特征(立体结构和化学键类型),性质也相近,其思维模型为![]()
等电子体的确定:
(1)同族元素换元法。如CO2的等电子体确定,可将O原子换为同主族原子得COs、CS2,注意不能将C原子换为Si原子,因为CO2和SiO2的结构不同(前者为分子晶体,后者为原子晶体),再如SO42-的等电子体确定,将一个O原子换为S原子得S2O32-。
(2)价电子迁移法,即将既定粒子中的某元素原子的价电子逐一转移给组成中的另一种元素原子,相应原子的质子数也随之减少或增加,变换为具有相应质子数的元素原子。如CO2的等电子体确定,C、O原子的价电子数分别为4、6,在价电子总数不变的情况下,C、O原子可分别换为(N-1)、(N+1),即换为两个N原子得N2O;也可将C、O原子依次换为(Be+2)、(Cl-1),即得BeCl2。
(3)电子电荷互换法,即将既定粒子中的某元素原子的价电子转化为粒子所带的电荷。如CN-的等电子体确定,可用N原子中的1个电子换作1个负电荷,则N原子换为C原子,离子带2个负电荷,其等电子体即为C22-;也可将CN-的电荷转化为1个电子,将该电子给C原子,即得N2,若给N原子即得CO。
【例4】(1)(2015·全国卷·改编)CS2分子中,C原子的杂化轨道类型是,写出两个与CS2具有相同空间构型和键合形式的分子或离子: (CO2,SCN-)
(2)科学家常用等电子体来预测不同物质的结构。据此原理,请你在表中①②③处填写相应的化学式及其中心原子的杂化轨道类型。
N2O | ② | COS | ④ |
① | N2H62+ | ③ | PH4+ |
综上所述,原子杂化轨道类型的判断思路比较简单,可以通过书写结构式来直接分析,可以运用价电子对互斥理论进行计算分析,也可以运用等电子原理去联想解答,具体解答的最佳思路可根据具体情况灵活运用。

- 全部评论(0)
(3206743010) 评论 href="/plus/view.php?aid=17751">原子轨道杂化类型判:十分的有用
