大π键的计算方法
时间:2019-05-14 10:12 来源:未知 作者:化学自习室 点击:次 所属专题: 大π键
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
1、概念:
由三个或三个以上的原子形成的π键。这种多个原子上相互平行的P轨道,它们连贯地“肩平肩”地重叠在一起而形成离域的化学键键,称其为大π键。 这种在化合物分子或离子中的π键电子不仅仅局限于两个原子的之间,而是在参加成键的多个原子形成的分子或离子骨架中运动。
2、形成条件:
(1)所有参与形成离域π键的原子必须在同一直线或同一平面上。所以中心原子只能采取sp2或sp1杂化。
(2)参与离域π键的原子都必须提供一个或两个互相平行的P轨道。
(3) 形成离域π键的P电子的总数小于P轨道数的两倍。
3、表示方法
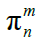
n为原子个数,m为共用电子个数,m ≦ 2n
4、m值的计算:
ABn型分子或离子
提醒:中心原子若有孤对电子,一定要把孤对电子从价电子总数中减去。
5、常见分子或离子的大π键
(1)ABn型分子
①CO2:2个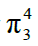
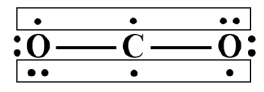
m值计算:m=4+6×2-2×2-2×2=8 >2n,所以分为2个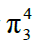 键
键
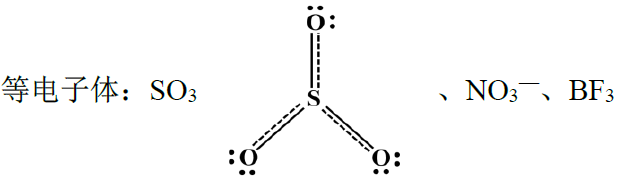
等电子体:
![]()
②O3:
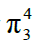
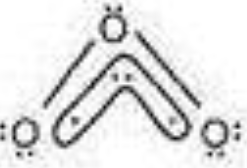
中心原子sp2杂化,所以中心原子中有1对孤对电子没有参与形成大π键
m值计算:m = 6×3-2×2-2-4×2 = 4
等电子体:
③ CO32-:
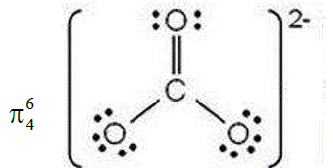
中心原子sp2杂化,中心原子的所有电子都参与成键
m值计算:m= 4+6×3+2-2×3-4×3 = 6
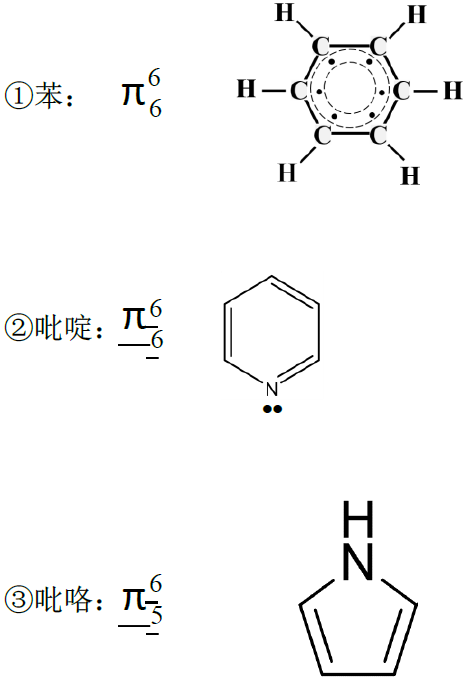
(2)环状分子
环上的原子都是sp2杂化
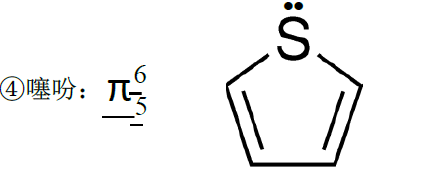
(责任编辑:化学自习室)

说点什么吧
- 全部评论(0)
(3453999613) 评论 大π键的计算方法:没看懂碳酸根离子怎么算大派键
(1736555026) 评论 大π键的计算方法:同问+1求速解
(848748377) 评论 大π键的计算方法:碳酸根的看不懂
(848748377) 评论 大π键的计算方法:碳酸根的看不懂
(36955) 评论 大π键的计算方法:碳酸根离子当中没有大派键
(36955) 评论 大π键的计算方法:碳酸根离子当中没有大派键
(2384620277) 评论 大π键的计算方法:要是没图,不还是没发推
(1806063938) 评论 大π键的计算方法:太棒了,!,,,,,,懂得都懂
(979458517) 评论 大π键的计算方法:也想问怎么看未参与的孤对电子
(780663621) 评论 大π键的计算方法:一目了然!!!yyds
(1593226483) 评论 大π键的计算方法:难呦!!!!!!!!!
(3440583959) 评论 大π键的计算方法:独Br!!!!!!!...
(3440583959) 评论 大π键的计算方法:独Br!!!!!!!....
(1342367823) 评论 大π键的计算方法:公式中未参与的孤对电子个数怎么看
(3234351651) 评论 大π键的计算方法:总结的太好了:-D
(1758276138) 评论 大π键的计算方法:就离谱太难了,有点看不懂
(853278170) 评论 大π键的计算方法:是的,共价键
(2668368656) 评论 大π键的计算方法:老师那个碳酸根最后减的4×3有点不懂,不是减去未成键的孤对电子?
(2668368656) 评论 大π键的计算方法:老师那个碳酸根最后减的4×3有点不懂,不是减去未成键的孤对电子?
(2936397631) 评论 大π键的计算方法:同意!感觉这个方法实际没用
(1730334983) 评论 大π键的计算方法:那我算O3和CO3根离子的大派键类型是还要画出它们的结构啊?但有些原子团不满足城建原
(1730334983) 评论 大π键的计算方法:那我算O3和CO3根离子的大派键类型是还要画出它们的结构啊?但有些原子团不满足城建原
(1730334983) 评论 大π键的计算方法:那我算O3和CO3根离子的大派键类型是还要画出它们的结构啊?但有些原子团不满足城建原
(1924728026) 评论 大π键的计算方法:氯化硼的怎么计算
(3603001660) 评论 大π键的计算方法:那啥,要怎么判定吡咯中N原子无不成键电子对啊
(2738976532) 评论 大π键的计算方法:总的,因为一个p轨道上最多容纳2个电子
(2494613846) 评论 大π键的计算方法:pai键也是共价键吧
(2494613846) 评论 大π键的计算方法:成氟离子时它的价电子为1
(16643461843) 评论 大π键的计算方法:讲的不错,奆奆奆奆奆奆奆奆奆奆奆奆奆奆奆奆奆奆奆奆奆奆
(1728878300) 评论 大π键的计算方法:小于p轨道数2倍中,是谁的p轨道?成键的还是总的?
(2388476670) 评论 大π键的计算方法:二氧化碳形成的不是双键吗
(2587374580) 评论 大π键的计算方法:BF3孤电子对是9单键是3价电子总数是24算出来是9啊哪里错了
(2587374580) 评论 大π键的计算方法:BF3孤电子对是9单键是3价电子总数是24算出来是9啊哪里错了
(1663389585) 评论 大π键的计算方法:围在元素外边的一对,叫孤电子对数有几个就乘几个
(2750857339) 评论 大π键的计算方法:请问计算m时,最后减去的 未参与的孤电子数 这个孤电子数怎么看
(2750857339) 评论 大π键的计算方法:请问计算m时,最后减去的 未参与的孤电子数 这个孤电子数怎么看
(2750857339) 评论 大π键的计算方法:请问计算m时最后减去 未参与的孤电子数,这个孤电子数怎么看?
(1092494286) 评论 大π键的计算方法:很有用!实用!解释很详细
(2195729596) 评论 大π键的计算方法:对不起对不起我不小心点了反对,我想问问这个算法是不是只是算得中心原子的孤电子对,
(2195729596) 评论 大π键的计算方法:对不起对不起我不小心点了反对,我想问问这个算法是不是只是算得中心原子的孤电子对,
(2195729596) 评论 大π键的计算方法:对不起对不起我不小心点了反对,我想问问这个算法是不是只是算得中心原子的孤电子对,
(2946072664) 评论 大π键的计算方法:有计算公式,(中心原子的价电子数-旁边原子的未成对电子数*n)/2即可
(2179354192) 评论 大π键的计算方法:价层电子对减去σ电子对
(2730425781) 评论 大π键的计算方法:怎么判断未参与的弧电子对啊?
(2730425781) 评论 大π键的计算方法:怎么判断未参与的弧电子对啊?
(1900516602) 评论 大π键的计算方法:大派键的解释中P电子什么意思啊
(2171088623) 评论 大π键的计算方法:图中的碳酸根离子的碳原子周围的电子有标错耶!一共应该有六对孤对电子,所以6×2=4
(2171088623) 评论 大π键的计算方法:图中的碳酸根离子的碳原子周围的电子有标错耶!一共应该有六对孤对电子,所以6×2=4
(2814294406) 评论 大π键的计算方法:那个m算出来是8对不对?然后有三个原子构成大∏键,而三个原子最多只能有6个电子,所
(2814294406) 评论 大π键的计算方法:那个m算出来是8对不对?然后有三个原子构成大∏键,而三个原子最多只能有6个电子,所
还没有评论,快来抢沙发吧!
