消除错误前概念 重新认识催化剂
时间:2020-03-09 12:52 来源:未知 作者:范晓凤 点击: 次 所属专题: 催化剂原理及应用
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、问题的提出
催化剂是现代化学中关键物质之一,据统计,约90%的工业产品是借助催化剂(工业上常称其为触媒)生产出来的,催化剂在化学工业中的普遍使用解决了现代人衣食住行中的许多问题。高考命题注重将学科内容与国家经济、社会发展、科学进步、生产生活实际等紧密联系,通过设置真实的问题情境,引导学生关注社会进步和科学发展。因此,催化剂成为近年高考的热点,命题素材和热门考点包括催化剂对反应速率和生产效率的影响、催化剂的选择性、催化剂的活性以及催化剂的回收等。
然而,催化剂又充满了神秘色彩,催化机理目前尚未完全明了。教材中对催化剂的介绍也不够深入,很多师生对催化剂的认识仅停留在“催化剂能改变化学反应速率”并用“质量和化学性质保持不变”作为催化剂的判据,知道催化剂降低反应所需活化能,加快反应速率,不能影响平衡移动,知其然却并不知其所以然,且对催化剂的概念、特征、组成、活性、选择性等知识的理解普遍存在误区,导致很多学生在高考中觉得催化剂“变脸”了,难于下手。
《普通高中化学课程标准(2017年版)》对催化剂的要求是“认识催化剂的研制对促进化学工业发展的重大意义”“围绕催化化学……等现代化学研究的重要领域,选取化学科学研究成果的典型案例,引导学生了解化学理论发展的方向和面临的挑战;提供参考的选题有:催化研究的新理论、新方法”。由于教师学科核心内容缺失、知识逻辑混乱,阻碍了化学核心素养的落地生根。笔者认为需要对催化剂进行更加深入的认识以提高教师的专业能力,下文针对高中化学教学及高考中有关工业催化剂的常见问题进行探讨。
二、催化剂的概念
催化剂是催化化学中最基本的概念之一,对催化剂概念的理解很重要。自19世纪三十年代贝采里乌斯提出“催化作用”的概念以来,随着对催化作用的认识不断深入,催化剂的概念在不断变化发展,在不同时期、不同国家的教材中的表述有差别(表1)。
表1 不同国家和不同版本的教材对催化剂概念的陈述
教材 | 催化剂概念的陈述 |
人教版《化学》九年级上册 | 在化学反应中能改变其他物质的化学反成速率,而本身的质量和化学性质在化学反成前后都没有改变的物质叫催化剂。 |
鲁科版《化学反位原理》(选修) | 催化剂是能加快化学反位速率而在反应前后本身的质量和化学性质不变的物质、 |
《普通化学原理》 (北京大学出版社,第4版) | 催化剂能显著地改变反应速率,但不影响化学平衡。凡能加快反应速率的催化剂称正催化剂,而减慢化学反应速率的催化剂则称负催化剂。一般说的催化剂是指正催化剂,常常把负催化剂叫抑制剂。 |
《化学概念与应用》(美国) | 催化剂是这样一类物质,它可以加快反应速率,但在反应过程中其身的性质不会发生永久性变化,也不会发生任何消耗。 |
由上面的例子可知,主要的分歧在于催化剂是“改变”反应速率还是“加快”反应速率。人教版《化学》使用广泛,参照人教版九年级《化学》对催化剂的定义,对于关键词“改变”,教师着重强调“不能片面理解为加快”,但是,人教版教材中没有出现“负催化剂”一词。催化剂参与反应为反应提供了一条新的路径,使反应所需活化能降低,而任何一个化学反应总是沿着它所能选择的“最省力”的反应路径来进行。因此,从反应机理看,催化剂加快了反应速率。另外,从中文释义看,“催”的释义有:①使赶快行动:如催促、催办;②使事物的产生、发展变化加快:如催化、催生、催熟、催眠等。这两个释义都只有“加快”的意思。
2014年国际纯粹与应用化学联合会(IUPaC)已经明确指出“催化剂这个术语不再用于指减慢化学反应速率的物质”,具有减慢反应速率作用的物质被称为“抑制剂”。由此,IUPAC已经将“催化剂”定义为“催化剂是增加反应速率但不改变总反应的标准吉布斯自由能的物质。催化剂既是反应的反应物,也是该反应的生成物。”很多场合,人们需要用抑制剂将不良反应的速率降低。
例如:双氧水容易分解,在装有H2O2的瓶子里加入一些抑制剂(如:焦磷酸钠等,通过吸附或络合等方式来抑制所含杂质Fe2+等的催化作用),可以防止它过快分解,延长双氧水的保质期。在这个过程中,络合型稳定剂被消耗,质量减少了。因此,催化剂概念的教学建议与时俱进,将“改变反应速率”变为“加快反应速率”。
三、催化剂的组成
因为双氧水分解的催化反应使用MnO2作催化剂,常使初学者形成错误认知:催化剂都是纯净物。事实上,工业催化剂除少数由单一物质组成外,一般都是由多种物质组成的混合体。一般催化剂由主催化剂、助催化剂和载体构成。
主催化剂是催化剂的活性成分,是起催化作用的根本物质。助催化剂是在催化剂中具有提高活性组分的活性和选择性,改善催化剂的耐热、抗毒和寿命等性能的组分。助催化剂通常可分为结构助催化剂和电子助催化剂。例如:合成氨所用的熔铁催化剂为FeO(29%~35%)和Fe3O4(55%~65%)的混合物经H2还原形成的活性铁微晶,助催化剂的成分为Al2O3(2%~4%)、MgO(3%~4%)和K2O(0.5%~0.8%)。Al2O3和MgO是结构型助催化剂,主要起骨架作用及增大催化剂表面、防止铁微晶长大和烧结的作用。K2O是电子型助催化剂,帮助铁把电子传给氮,有利于氮的吸附和活化。
载体是催化活性组分的分散剂、黏合剂或支撑体,是负载活性成分的骨架。载体种类繁多,包括天然载体和人工载体,常见的载体有沸石、硅胶、分子筛、Al2O3、活性炭、硅藻土等。例如:Au、Ag、Pt、Pd等过渡金属具有优良的催化性能,但它们都相当稀贵,而催化反应却只在催化剂表面进行,因此选用硅胶(SiO2)、γ-Al2O3、硅藻土、分子筛等多孔物质作为载体,将具有催化活性的过渡金属浸渍于上,1g 载体的表面积可达几百平方米,这就大大提高了催化效率。
四、催化剂的特征
中学教学中常用“质量和化学性质保持不变”作为催化剂的特征和判据。但是,实际反应中,很多“质量和化学性质保持不变”的物质不是催化剂。例如:锌和稀硫酸反应,铜可以加快该反应的速率,虽然符合“反应前后质量和化学性质不变”的特点,但由于铜没有参与反应形成过渡状态或中间物质,没有降低活化能,而是仅为氢气提供吸附和脱附的载体,故铜不是锌与硫酸反应的催化剂。区分某种物质是否为催化剂,需要关注催化剂的本质特征。
催化剂有四个基本特征:
第一,催化剂只能加速热力学上可能发生的反应,而不能加速热力学上无法进行的反应。因此,判断某个反应是否需要采用催化剂时,首先要看这个反应在热力学上是否容许,即反应的自由焓ΔG=ΔH-TΔS<0。如:常温常压、无外界条件影响下,水不能自发分解为O2和H2,因而不存在能加快该反应的催化剂。
第二,催化剂只能加快反应速率,不能改变平衡常数。对于可逆反应,催化剂既是正反应的催化剂,又是逆反应的催化剂。例如:一个催化剂对加氢反应有良好效果,同样对脱氢反应也有效。
第三,催化剂对反应具有选择性。催化剂具有选择性包含两重含义:一是不同的反应物应选择不同的催化剂;二是同样的反应物选择不同的催化剂可获得不同的产物。
第四,催化剂在特定的条件下才能体现出它的活性,否则将失活。从短时间看,催化剂在反应前后化学组成等不会发生显著变化,但物理状态可能变化,有些杂质还可能让催化剂发生不可逆转的中毒。例如:氨的催化氧化的铂丝用几个星期也变黑了。判断物质是否扮演催化剂的角色,除了要从催化剂的本质特征看,还要判断该物质是否为物质实体、是否起到化学作用等因素。
五、辨析有关催化剂的几个问题
概念有时只反映物质的部分属性,在中学教学过程中介绍新的概念的时候,由于学生的认知能力有限,很难充分理解概念的全部内涵。教师若只是简单地概括几个注意点和所谓的判据,便让学生应用概念解决问题,很容易造成以偏概全或错误理解。错误的前概念是后续学习的障碍,因此,有必要对催化剂的几个重要问题进行辨析。
1.催化剂没有参与反应吗?
在初中的教学中,很多师生认为“催化剂没有参与反应”,证据是:反应前后催化剂的质量没有改变。显然,该证据是片面的,催化剂未参与反应很难加快反应速率。使用催化剂能增大反应速率的机理主要是形成中间产物,从而改变反应的途径(或受催化剂表面的活性中心的影响,被吸附的分子会变形而与催化剂形成活泼的吸附活化络合物),使反应活化能降低。如:乙醇的催化氧化反应中,铜作为催化剂,先与氧气反应,生成的氧化铜再与乙醇反应变回铜。虽然催化的机理非常复杂,但可以依此建立简单的催化剂参与反应的模型:
若总反应为:![]() ,则过程可以是:①A+x
,则过程可以是:①A+x AX ( X参与反应,被消耗)② AX+B
AX ( X参与反应,被消耗)② AX+B C + d+X (X再生)
C + d+X (X再生)
英国化学家欣谢尔伍德(Cyril Norman Hinshelwood),以碘蒸气为催化剂,进行乙醛蒸气的受热分解实验,发现均相催化(指催化剂和反应物居于同一相态中的反应,可分气相均相催化反应和液相均相催化反应)的反应速率与催化剂的浓度成正比,而催化剂的浓度反应前后保持不变,从而证明了中间化合物理论的正确性。
2.催化剂与中间产物如何区别?
中间产物与催化剂一样不出现在总反应中,但与催化剂有区别。催化剂先在反应中消耗,再在后续的反应中生成,而中间产物则相反,先生成,后消耗。如:I-催化双氧水分解的过程为:第一步:H2O2(aq)+I-(aq)→IO-(aq)+H2O(l);第二步:H2O2(aq)+IO-(aq)→I-(aq)+H2O(l)+O2(g)。其中I-为催化剂,IO-则为中间产物。
3.催化剂都是通过降低活化能加快反应速率的吗?
过渡状态理论还提出了活化熵的概念,认为由反应物到达过渡状态,不仅要克服能垒(类似于“爬山”),而且要考虑活化熵——找到爬的“路径”或考虑峰顶的面积。活化熵越大,意味着上山的路径比较多或峰顶大,反应物就越容易变成活化络合物。在阿伦尼乌斯公式中,活化熵包含在指前因子中(对于有效碰撞理论则在取向因子中)。大多数反应,活化熵对反应速率的影响相对于活化能是可以忽略的,但有些催化剂是通过改变活化熵来加速化学反应,特别是酶催化反应。
4.催化剂降低活化能为何能极大地加快反应速率?
活化能相当于化学反应的“门槛”。其他条件相同时,根据阿伦尼乌斯方程
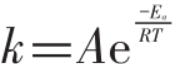 ,
,
反应速率常数(式中A为指前因子,也叫碰撞频率因子;R为气体常数;T为热力学温度,Ea为活化能,E为自然对数的底)。由于活化能Ea处在指数项上,当指前因子A值不变时,只要稍微降低活化能,就可以使反应速率常数增大很多。如:SO2转化为SO3反应所需活化能原来在200 KJ·mol-1以上,使用V2O5作催化剂时活化能降低为92~96KJ·mol-1,反应速率可增大约1亿倍。一个反应可以有不同的催化剂,活化能降低的也不同。例如:H2O2分解为H2O和1/2O2的反应活化能Ea=75KJ·mol-1。若用I-作催化剂,活化能降低为59KJ·mol-1;若用过氧化氢酶作催化剂,可降低为25KJ·mol-1。
5.为什么催化剂不能影响平衡移动?
研究一个化学反应应该考虑两个方面的问题。
第一是:这个反应能否进行?若能进行,它能够进行到什么程度?也就是能走多远的问题。化学平衡的位置是由热力学决定的:ΔGӨ=-RTlnKp。其中Kp为反应的平衡常数,ΔGӨ是产物与反应物的标准自由能之差,是状态函数,只决定于始终态,而与过程无关。
第二个问题是:热力学上可行的反应进行快慢如何?即需要多久能够到达平衡的位置,这个问题属于化学动力学的范畴。催化剂的存在不影响ΔGӨ值,它只能缩短达到平衡所需的时间。
六、理解化工生产中有关催化剂的几个问题
1.如何理解催化剂能提高生产效率?
催化剂不能影响平衡移动,却为何能提高生产效率?这让人感到困惑。这里需要区分生产效率和转化率。化工生产中,非均相催化反应常采用流化床的方式进行。即在核心反应器中填装催化剂,反应气体以一定的流速流入反应器,在催化剂的表面反应,产物及未反应的原料气从反应器另一端流出。这样的生产方式既可能达到了平衡状态,也可能未达到平衡状态。一方面,生产效率与时间有关,达到平衡需要时间,而实际生产中大多数反应未达到平衡就流出反应器,所以实际转化率总比平衡转化率低。但反应速率提高,单位时间内产量提高了,目标产物的产率[(实际产量/理论产量)×100%]相应得以提升。另一方面,催化剂可以提高反应的选择性,故也可以提高目标产物的产率。
2.如何理解催化剂的选择性?
催化剂的选择性是指给定反应物中某产物的生成量与已转化的原料量的比。同一原料在热力学上可以沿着几个途径进行反应,选用不同的催化剂会有利于不同产物的生成(表2)。
表2 乙醇在不同催化剂和不同条件下的反应产物
反应物 | 催化剂及反应温度 | 产物 |
Cu,473〜523K | CH3CHO+H2 | |
CH3CH2OH | Al2O3,623〜633K | C2H4+H2O |
H2SO4,412.3K | (C2H5)2O+H2O | |
ZnO-Cr2O3,673.2~773.2K | CH2=CH-CH =H2+H2O+H2 |
不同的催化剂之所以能促使某一反应向特定产物的方向进行,是因为这种催化剂在多个可能同时进行的反应中,使生成特定产物的反应活化能降低程度远远大于其他反应活化能的变化,使反应容易向生成特定产物的方向进行。选择性实质上是反应系统中目标反应与副反应间反应速率的竞争,这与反应的特征、反应条件、反应活化中心的活性等因素有关。
提高催化剂的选择性的常用方法有:
(1)加入某种毒物以毒化引起副反应的活性中心,从而提升选择性。
(2)降低反应温度,降温可以使低活化能反应的选择性提高。升高温度虽然对高活化能反应的速率提升更明显,但往往对设备提出了很高的要求,且需考虑温度对副反应、催化剂的活性的影响,还需要考虑能耗及局部温度过高可能引发爆炸等问题。
(3)改变孔口的大小。对于具有规则孔结构的分子筛催化剂,可利用孔口的大小改变选择性(称为形状选择性),只容许尺寸小于孔口的反应物进入催化剂孔隙内部发生催化作用。催化剂的选择性和催化作用的专一性,使石油化工受益匪浅。
例如:天然沸石孔径大小不均匀,若用于石油的催化裂化,要将16个碳原子的长链断成8个碳原子的碳链,天然沸石可能会将碳链再断得更短,导致产物分子碳链长短不一,选择性差。如果改用人工合成的孔径大小一致的沸石,则目标产物较多,选择性好。
3.如何理解催化剂失活?
理论上,催化剂反应前后质量保持不变,可以无限循环使用,一定量的催化剂可以使大量的反应物转化为大量的产物。但实际生产过程中,在长期的高温环境下,会发生物理和化学变化,导致催化剂的失活。
一般气体在固体催化剂的表面反应要经过扩散、吸附、活化反应、脱附、扩散五个步骤。“多位理论”指出固体催化剂的表面是不均匀的,位于催化剂表面微晶的棱和顶角处的原子因为具有不饱和键而形成了活性中心。在催化过程中,只在活性中心才有催化反应发生。如果催化剂表面活性中心的空间结构与反应分子将发生变化的结构呈几何对应关系,则被吸附的分子容易变形活化,即旧键较容易松弛,新键较容易形成。催化剂的活性中心在不同催化剂中是不一样的,它可以是一个质子、固体表面的不饱和原子、表面原子簇、络合物、蛋白质上的胶囊束等。
催化剂失活是指在恒定反应条件下进行的催化反应的转化率随时间增长而下降的现象。催化剂的失活有三种类型:化学失活、热失活和机械失活。化学失活是由于有毒杂质对催化剂的毒化作用,使催化剂活性、选择性和稳定性降低的现象,也叫催化剂中毒。催化剂的毒物通常是一些含硫、磷、砷的化合物以及卤素化合物、重金属化合物等。这些毒物比较容易吸附在催化剂的活性中心上,并且不容易脱附出来。防治办法是在反应之前除去毒物。例如:合成氨中H2S、O2、CO等杂质气体会使催化剂中毒,必须用[Cu(NH3)2]Ac洗气。大多数催化剂都有有效使用温度范围(工业上称为温度窗口宽),超过范围活性就会降低甚至完全丧失。温度对催化剂的影响是多方面的,它能使催化剂活性组分挥发、流失,负载活性组分烧结或微晶粒长大,结果导致催化剂结构发生改变、活性中心较少。机械失活指固体催化剂颗粒在抵抗摩擦、冲击等过程中导致破坏。颗粒破碎会使催化剂床沟流堵塞。结焦积炭也是一种常见的机械失活,由于积炭覆盖在催化剂活性中心,导致催化剂活性中心减少、堵塞。积炭失活后可烧炭再生,即通过将催化剂孔隙中的含碳沉积物氧化为CO和CO2除去可恢复催化活性。
七、反思与总结
化学家查德·哲尔(Richard Zare)说过:要我选一个最能概括化学的词,莫过于“催化剂”,没有其他东西能与之媲美。现代工业的巨大成就离不开催化剂的广泛研发和应用,催化剂的重要性还体现在工艺技术和产品创新、能源综合利用和环境保护所带来的巨大经济效益和社会效益,一般认为每1元的催化剂可以生产200~1000元的产品。因此,催化剂的研发是现代化学工业的核心问题之一。教师和学生应该自觉掌握催化剂的相关知识,全方位认识催化剂的特征、了解其在现代化学工业中的广泛应用。
教学中把头脑中存在的与科学概念不一致的认识叫做“迷思概念”。催化剂无疑是典型的迷思概念。造成迷思概念的原因是多方面的:首先,概念都具有相对性,很多概念都是在历史发展中不断自我完善的,随着科学家对事物本质认识的深入而不断发展;其次,学生的认知水平有局限性,不能一次性地将概念理解到位,学习处于螺旋上升的状态;再者,部分教师缺乏钻研精神,没有及时更新知识,在教学中只传授静态的、结论性的知识,无法引导学生进行深度学习。因此,在中学化学概念教学过程中,既要让学生通过观察、体验等手段认识宏观现象,形成感性认识,还要调动学生通过分析、推理、查证等方式认识微观过程,达到对事物的理性认识。课堂教学应从教授“是什么(知识性知识)”逐渐向“为什么(逻辑性推理)”和“怎么办(程序性应用)”转变,揭开迷思概念的面纱,认识它本来的面貌。课堂教学,应该让思维深刻发生,让素养生根发芽。

- 全部评论(0)
