用假设思想解化学平衡题
时间:2020-03-14 10:01 来源:未知 作者:化学自习室 点击: 次 所属专题: 假设法
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、极端假设
例1、在一密闭容器中进行反应:2SO2(g)+O2(g) 2SO3(g)。已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol·L-1、0.1mol·L-1、0.2mol·L-1。当反应达到平衡时,可能存在的数据是( )
2SO3(g)。已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol·L-1、0.1mol·L-1、0.2mol·L-1。当反应达到平衡时,可能存在的数据是( )
A. SO2为0.4mol·L-1,O2为0.2mol·L-1
B. SO3为0.25mol·L-1
C. SO2、SO3均为0.15mol·L-1
D. SO3为0.4mol·L-1
分析:A项数据表明,题中0.2mol·L-1的SO3完全转化成了SO2和O2即平衡时c(SO3)=0,这是不可能的;b项数据表明在题给浓度的基础上又有0.05mol·L-1SO2和0.025mol·L-1O2化合成0.05mol·L-1SO3,这是可能的;C项数据表明SO2、SO3的浓度都是在原浓度基础上减少了0.05mol·L-1,这也是不可能的;D项数据表明SO2完全转化成了SO3,即平衡c(SO2)=0c(O2)=0,这也是不可能的。
答案:B
二、过程假设
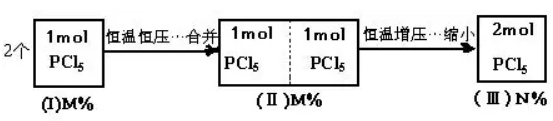
例2、一容积恒定的密闭容器中盛有1mol PCl5,加热到200℃时发生反应:PCl5(g) PCl3(g)+Cl2(g),反应达到平衡时,PCl5所占体积百分数为m%,若在同一温度下和同一容器中,最初投入的是2mol PCl5,反应达到平衡时,PCl5所占体积百分数为n%,则m和n的正确关系是()
PCl3(g)+Cl2(g),反应达到平衡时,PCl5所占体积百分数为m%,若在同一温度下和同一容器中,最初投入的是2mol PCl5,反应达到平衡时,PCl5所占体积百分数为n%,则m和n的正确关系是()
A. m>n
B. m<n
C. m=n
D. 无法比较
分析:两个容积相同的容器各装有1mol PCl5,建立完全相同的平衡状态,PCl5所占体积百分数为m%;以m%的两个状态(I)合并成过渡状态(Ⅱ),因外界条件不变,状态(Ⅱ)中PCl5的体积百分数仍为m%;恒温下加压,使状态(Ⅱ)体积缩小一半,则构成状态(Ⅲ),它相当于在原容器中加入2mol PCl5后达到的平衡状态。在状态(Ⅱ)→状态(Ⅲ)的过程中,因压强增加,状态(Ⅱ)中化学平衡向逆反应方向移动,PCl5的体积百分数增大,即n%>m%。其思路可用下图表示:
答案:B
三、状态假设
例3、在密闭容器中的一定量混合气体发生反应:a A(g)+b B(g) Cc(g),达到平衡后,测得a的浓度为0.7mol·L-1,在温度不变的情况下,将容器的容积扩大到原来的两倍,测得a的浓度为0.4mol·L-1,则下列判断正确的是()
Cc(g),达到平衡后,测得a的浓度为0.7mol·L-1,在温度不变的情况下,将容器的容积扩大到原来的两倍,测得a的浓度为0.4mol·L-1,则下列判断正确的是()
A. a+b<c
B. C的体积分数下降
C. B的浓度增大
D. A的转化率增大
分析:假设改变条件平衡不发生移动,则a的浓度应该为0.35mol·L-1,但现在为0.4mol·L-1,说明平衡向生成A的方向(逆向)移动了,则C的体积分数下降,A、B的转化率减小;扩大容积等效于减小压强,所有物质的浓度均减小,反应速率均减慢;减小压强平衡向逆反应方向移动,说明左边气体的化学计量数之和大于右边,即a+b>c。
答案:B
四、可能假设
例4、在一密闭的容器中充入2mol A和1mol B,发生反应2A(g)+B(g) xC(g),达到平衡后,C的体积分数为w%;若维持容器的容积和温度不变,按起始物质的量A:0.6mol、B:0.3mol、C:1.4mol 充入容器,达到平衡后,C的体积分数仍为w%,则x的值()
xC(g),达到平衡后,C的体积分数为w%;若维持容器的容积和温度不变,按起始物质的量A:0.6mol、B:0.3mol、C:1.4mol 充入容器,达到平衡后,C的体积分数仍为w%,则x的值()
A.只能为2
B.只能为3
C.可能为2,也可能为3
D.无法确定
分析:这是一道关于在恒温恒容条件下的等效平衡问题,应该分x=3和x≠3两种情况进行分析。由题给条件分析可得C项正确。
答案:C
例5、在恒温恒容的密闭容器中进行反应A(g) B(g)+C(g);ΔH>0。若反应物浓度由4mol·L-1降到1.6mol·L-1需40S,那么反应物浓度由1.6mol·L-1降到0.4mol·L-1所需时间()
B(g)+C(g);ΔH>0。若反应物浓度由4mol·L-1降到1.6mol·L-1需40S,那么反应物浓度由1.6mol·L-1降到0.4mol·L-1所需时间()
A.等于20S
B.大于20S
C.小于20S
D.无法判断
分析:由平均反应速率的计算公式,可计算出浓度由1.6mol·L-1降到0.4mol·L-1所需时间为20S。但是,由于浓度越低反应速率越慢,所以,实际需要的时间会大于20S。
答案:B
六、等效假设
例6、将2.0mol SO2气体和2.0mol SO3气体混合于固定容积的密闭容器中,在一定条件下发生反应:2SO2(g)+O2(g) 2SO3(g),达到平衡时SO3为n mol。在相同温度下,分别按下列配比在相同密闭容器中放入起始物质,平衡时SO3等于n mol 的是( )
2SO3(g),达到平衡时SO3为n mol。在相同温度下,分别按下列配比在相同密闭容器中放入起始物质,平衡时SO3等于n mol 的是( )
A. 1.6mol SO2+0.3mol O2+0.4mol SO3
B. 4.0mol SO2+1.0mol O2
C. 2.0mol SO2+1.0mol O2+2.0mol SO3
D. 3.0mol SO2+1.0mol O2+1.0mol SO3
分析:依据恒温恒容下建立等效平衡的条件:投料量相等。将备选项中O2完全转化后,得如下数据:
A. 1.0mol SO2+1.0mol SO3
B. 2.0mol SO2+2.0mol SO3
C. 4.0mol SO3
D. 1.0mol SO2+3.0mol SO3
与题干比较,可知只有B项符合题意。
答案:B
七、赋值假设
例7、下列的可逆反应在一定条件下达到平衡后,2A(g) B(g)+xC(g),容器内压强增加了p%,A的转化率也为p%,则x的值为( )
B(g)+xC(g),容器内压强增加了p%,A的转化率也为p%,则x的值为( )
A. 1
B. 2
C. 3
D. 4
分析:假设起始容器内充入2mol A,并令p=100,即2mol A完全分解时,容器内的压强增加了一倍,从而由题中的反应式速推x=3。
答案:C
八、反证假设
例8、已知氟化氢气体中存在着下列平衡:2(HF)3 3(HF)2,(HF)2
3(HF)2,(HF)2 2HF。若平衡时气体的平均摩尔质量是42g·mol-1,试论证(HF)3的体积分数必大于10%。
2HF。若平衡时气体的平均摩尔质量是42g·mol-1,试论证(HF)3的体积分数必大于10%。
解析:设(HF)3占的体积分数为X,(HF)2占的体积分数为Y,则HF占的体积分数为1-x-y。则:60x+40y+20×(1-x-y)=42,化简为2x+y=1.1,因为1-x-y>0,x+y<1,所以x=1.1-(x-y)>0.1 ,即(HF)3的体积分数必大于10%。

- 全部评论(0)
(3047531663) 评论 href="/plus/view.php?aid=17958">用假设思想解化学平:最后一段应该是x=1.1-(x+y)吧
