如何理解等效平衡?
时间:2020-02-21 11:02 来源:未知 作者:化学自习室 点击: 次 所属专题: 等效平衡
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
1.含义
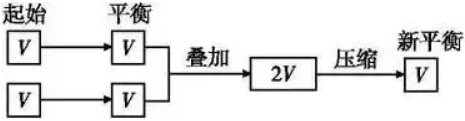
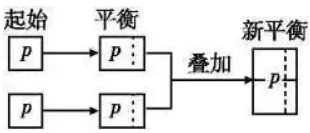
(1)化学平衡状态与建立平衡的条件有关,与建立平衡的途径无关。 (2)对于同一可逆反应,在一定条件(恒温恒容或恒温恒压)下,无论是从正反应(反应物)、逆反应(生成物)或从中间状态(既有反应物、也有生成物)开始,只要建立平衡后,平衡混合物中各组分的比例相同,或各组分在混合物中的百分含量相等,这样的化学平衡互称为等效平衡。 (3)注意只是组分的百分含量相同,包括体积百分含量、物质的量百分含量或质量百分含量,而各组分的浓度不一定相等。 2.审题方法 (1)注意反应特点:反应前后气体的物质的量是否发生变化。 (2)分清平衡建立的条件:是恒温恒压还是恒温恒容。 3.理解等效平衡的意义 (1)对于反应前后气体物质的量有变化的反应,如2SO2(g)+O2(g) 容易得出A与C等效,A与D不等效。因为C→D是对反应前后气体体积有变化的反应加压,平衡发生了移动。 结论:对于反应前后气体物质的量有变化的反应,恒温恒压时只要起始加入的物质按方程式化学计量数转化到方程式一侧,比例相同就可建立等效平衡;而恒温恒容时,则需起始加入的物质按方程式化学计量数转化到方程式一侧,完全相同才能建立等效平衡,因为反应物物质的量的变化会引起平衡的移动。 (2)对于反应前后气体物质的量没有变化的反应,如:H2(g)+I2(g) 容易得出A与C等效,A与D等效。因为C→D平衡不发生移动。对反应前后气体体积不变的反应加压,平衡不移动。 结论:对于反应前后气体物质的量不变的反应,无论是恒温恒压还是恒温恒容,只要加入的物质按方程式化学计量数转化到方程式一侧,比例相同就可建立等效平衡。 4、等效平衡应用:构建“虚拟的第三平衡”法解决平衡间的联系 在解题时若遇到比较条件改变后的新、旧平衡间某量的关系有困难时,可以考虑构建一个与旧平衡等效的“虚拟的第三平衡”,然后通过压缩或扩大体积等手段,再与新平衡沟通,以形成有利于问题解决的新模式,促使条件向结论转化,例如: (1)构建等温等容平衡思维模式:新平衡状态可认为是两个原平衡状态简单的叠加并压缩而成,相当于增大压强。 (2)构建等温等压平衡思维模式(以气体物质的量增加的反应为例(见图示):新平衡状态可以认为是两个原平衡状态简单的叠加,压强不变,平衡不移动。 2SO3(g)等温等压、等温等容下建立平衡如下图:
2SO3(g)等温等压、等温等容下建立平衡如下图: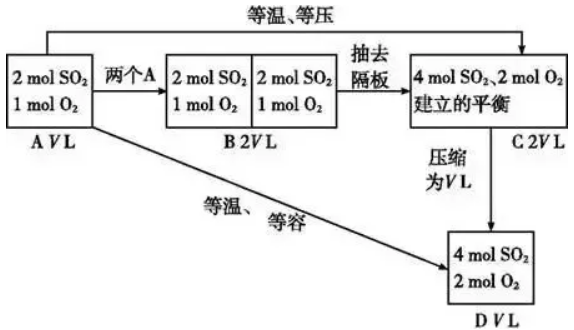
 2HI(g)等温等压、等温等容下建立平衡如下图:
2HI(g)等温等压、等温等容下建立平衡如下图: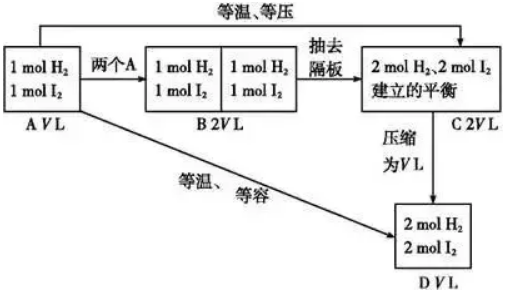

- 全部评论(0)
