催化剂能提高产率吗?
时间:2020-03-25 10:46 来源:未知 作者:张劲辉 点击: 次 所属专题: 催化剂 产率
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
许多同学一看到催化剂,就想到它不会影响平衡的移动,从而产率不变,这是把产率和转化率两个概念混淆了。
高考试题中这两个概念是分得非常清楚的,一般是表述为某物质的产率,或者会强调是某物质的平衡产率。另一个是某物质的平衡转化率。催化剂不会影响平衡的移动,是不会影响平衡转化率的。
化工生产上,反应常采用工业流化床方式进行。反应气体以一定的流速和一定压强进入,填有催化剂温度恒定的反应器中,并从反应器后端口流出产物与未反应的原料气。这样生产方式进行的反应可以是在平衡状态下,也可以是在非平衡状态下。
所以化工生产要考虑生产效率问题,不一定要等到反应达到平衡状态。化学反应往往是在非平衡状态进行,化工上的产率,它包括生产效率的意思在内。意思就是反应速率越快,单位时间生产效益提高了,某物质的产率就提高了。
使用催化剂可以提高物质的产率。
首先是使用催化剂可以加快反应速率,那当然就可以提高生产效率。
其次是催化剂有选择性和专一性,化工生产时,可以控制反应条件,选择一种合适的催化剂。选择高效、高选择性的催化剂,只催化主反应,而对副反应不起作用,从而加快主反应的反应速率,减少了副反应,提高主反应中产物的产率。
一定要避免学生产生这样错误的想法:“使用催化剂,所有的反应都是加快反应速率的”。
催化剂有以下特点:
①在适宜的温度(活化温度)下使用,否则会降低效率
②会中毒,工业上对原料要净化
③催化剂能改变活化能,但不能改变焓变
④催化剂对同一反应的正逆反应同时影响
例1、(2014福建省质检12)
硝酸生产中,500℃时,NH3和O2可能发生如下反应:
①4NH3(g) + 5O2(g)=4NO (g) + 6H2O (g) ΔH=-9072kJ·mol-1 K=1.1×1026
②4NH3(g) + 4O2(g)=2N2O (g) + 6H2O(g) ΔH=-1104.9kJ·mol-1 K=4.4×1028
③4NH3(g) + 3O2(g)=2N2(g) + 6H2O(g) ΔH=-1269.02kJ·mol-1 K=7.1×1034
其中,②、③是副反应。若要减少副反应,提高NO的产率,最合理的措施是
A.减小压强 B.降低温度 C.增大O2浓度 D.使用合适的催化剂
解析:题意的关键是“减少副反应,提高NO的产率”,就是要进行主反应①,抑制②、③两个副反应。
可看出三个反应的K都特别大,就是它们的热力学趋势很大,②、③的平衡常数比主反应①还大,所以从热力学的角度来分析是不行的,只能从动力学角度来分析,从反应速率入手,选择一种合适的催化剂,只催化主反应,而对副反应不起作用,从而加快主反应的反应速率,反应大部分按照①式进行,自然“减少了副反应,提高了NO的产率”。
这样答案自然就是D。(参考了摩尔盐博客,表示致谢)
例2、(2016全国新课标2卷27)
27. (1)丙烯腈(CH2=CCN)是一种重要的化工原料,工业上可用“丙烯氨氧化法”生产。主要副产物有丙烯醛(CH2=CHCHO)和乙腈(CH3CN)和副产物丙烯醛(C3H4O)的热化学方程式如下:
①C3H6(g) + NH3(g) + 3/2O2(g)==C3H3N(g)+3H2O(g) ΔH= −515 kJ·mol−1
②C3H6(g) +O2(g)==C3H4O(g) +H2O(g) ΔH= −353 kJ·mol−1
两个反应在热力学上趋势均很大,其原因是两个反应均为放热量大的反应;有利于提高丙烯腈平衡产率的反应条件是降低温度、降低压强;提高丙烯腈反应选择性的关键因素是催化剂。
(2)图(a)为丙烯腈产率与反应温度的关系曲线,最高产率对应的温度为460℃。低于460℃时,丙烯腈的产率不是(填“是”或“不是”)对应温度下的平衡转化率,判断理由是该反应为放热反应,平衡产率应随温度升高而降低;
高于460℃时,丙烯腈产率降低的可能原因是AC(双选,填标号)。
A.催化剂活性降低 B.平衡常数变大
C.副反应增多 D.反应活化能增大
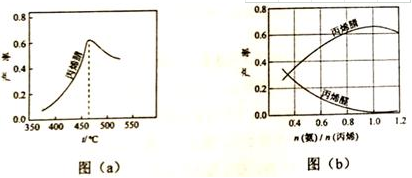
(3)丙烯腈和丙烯醛的产率与n(氨)/N(丙烯)的关系如图(b)所示。由图可知,最佳n(氨)/n(丙烯)约为1,理由是该比例下丙烯腈产率最高,而副产物丙烯醛产率最低。进料气氨、空气、丙烯的理论体积比约为1:7.5:1。
解析:从题目中可以看出“丙烯腈平衡产率”“平衡转化率”与“丙烯腈产率”是区分的非常清楚的。题目为了降低难度,特别设问“提高丙烯腈反应选择性的关键因素是”就是提示考生要从催化剂的角度来思考问题。
许多同学疑惑是就是“高于460℃时,丙烯腈产率降低的可能原因是”就是A催化剂活性降低,C副反应增多。该反应是放热反应,温度升高,该反应的平衡常数变小,B选项错误。
反应活化能与温度有没有关系呢?经查找文献认为活化能与温度无关。
例3、(2017全国新课标2卷27)27.(14分)丁烯是一种重要的化工原料,可由丁烷催化脱氢制备。回答下列问题:
(1)正丁烷(C4H10)脱氢制1-丁烯(C4H8)的热化学方程式如下:
①C4H10(g)=C4H8(g)+H2(g) ΔH1
②C4H10(g)+1/2O2(g)= C4H8(g)+H2O(g) ΔH2=−119kJ·mol−1
③H2(g)+1/2O2(g)= H2O(g) ΔH3=−242kJ·mol−1
反应①的ΔH1为+123kJ·mol−1。图(a)是反应①平衡转化率与反应温度及压强的关系图,x小于0.1(填“大于”或“小于”);欲使丁烯的平衡产率提高,应采取的措施是AD(填标号)。
A.升高温度 B.降低温度 C.增大压强 D.降低压强
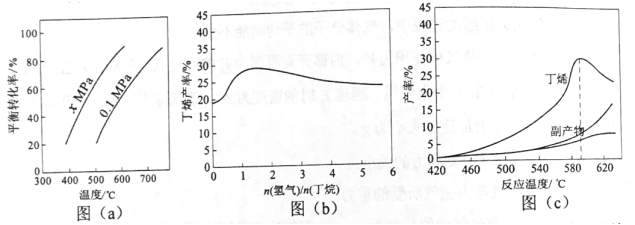
(2)丁烷和氢气的混合气体以一定流速通过填充有催化剂的反应器(氢气的作用是活化催化剂),出口气中含有丁烯、丁烷、氢气等。图(b)为丁烯产率与进料气中n(氢气)/n(丁烷)的关系。
图中曲线呈现先升高后降低的变化趋势,其降低的原因是氢气是产物之一,随着n(氢气)/n(丁烷)增大,逆反应速率增大。
(3)图(c)为反应产率和反应温度的关系曲线,副产物主要是高温裂解生成的短碳链烃类化合物。
丁烯产率在590℃之前随温度升高而增大的原因可能是升高温度有利于反应向吸热方向进行、温度升高反应速率加快;590℃之后,丁烯产率快速降低的主要原因可能是丁烯高温裂解生成短链烃类。
解析:从题目中可以看出“丁烯的平衡产率”与“丁烯产率”是区分的非常清楚的。
1、问题(2)分析
前面说到化工生产上,反应常采用工业流化床方式进行。这样生产方式进行的反应可以是在平衡状态下,也可以是在非平衡状态下。所以图(b)纵坐标是“丁烯产率”,不是图(a)中的“平衡产率”。
这里的曲线为什么是先升高后降低呢?按照平衡移动,氢气增加,丁烯产率要下降。而曲线升高,那只能考虑反应速率快,丁烯生产效率提高。原因是氢气活化催化剂使得反应速率加快。后面氢气的量满足催化剂活化需求之后,再增大氢气的量,氢气作为逆反应的反应物,反而加快了逆反应速率造成丁烯产率下降。
2、问题(3)分析
与前两个图不同,图(c)的纵坐标又换成了“产率”,同样反应可以是在平衡状态下,也可以是在非平衡状态下。
590℃之前产物的产率随着温度升高而增大,一是温度越来越高,反应速率越快,产率增大。二是升高温度有利于反应向吸热方向进行。
而590℃之后产率的变化主要是丁烯不稳定,高温裂解成短碳链烃类。当然还可能是发生了其他副反应,这主要根据题给信息来回答。
通过这几题可以看出工业上的产率往往得生产效率,也就是反应速率,反应速率越快,产率就越大,使用特定的催化剂可以加快某个反应的反应速率,那就可以提高某些物质的产率。
若温度升高,就会降低了催化剂的活性,产率就下降。

- 全部评论(0)
