关于催化剂的几个问题
时间:2021-11-02 09:25 来源:未知 作者:王笃年 点击: 次 所属专题: 催化剂
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
在中学化学里,催化剂似乎是一个神秘的存在,其实,催化剂也是反应物之一,只是它先与一部分反应物作用形成了反应中间体,之后中间体再与另外的 反应物作用,得到产物的同时,又把催化剂释放出来。所以,作为学科学的学生,可以赞赏催化剂神奇的作用,但不要将其神秘化。
1、催化剂的作用机理是怎样的?
不同类型的催化剂其作用机理是不同的,有的催化剂与反应物属于完全相同的状态,它们均匀地混合于同一体系内相互作用,这属于均相催化,而有的催化剂是通过表面吸附作用发挥催化效用的。
a、均相催化
比如,利用NO2催化SO2的氧化反应:
![]()
其具体作用过程可理解为:第1步反应是SO2+NO2=SO3+NO,产生的SO3用水吸收,生成硫酸后,NO不溶于水,再与O2发生第2步反应2NO+O2=2NO2,使得催化剂NO2得以再生。这本是一个很好的流程,历史上称为“硝化法”,但由于NO会被较浓的硫酸氧化吸收,此法不能制得浓硫酸,故逐渐被“接触法”取代。
再如乙醇脱水制乙烯的反应:
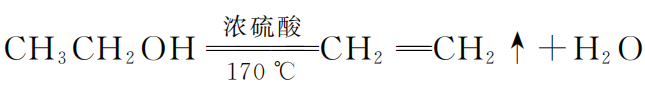
不知大家学习时是否产生过这样的疑问:“乙醇的沸点只有 78.5 ℃,它能在反应体系内等温度升高到170 ℃再脱水变成乙烯吗?”
这个“奥秘”其实就在催化剂浓硫酸这里,此反应原料配比一般是浓硫酸与乙醇体积比3∶1,在二者混合过程中,浓硫酸先行与乙醇发生了如下酯化反应:
CH3CH2OH+HOSO3H→CH3CH2OSO3H+H2O,
其产物CH3CH2OSO3H叫“硫酸氢乙酯”,沸点高达260 ℃,当然不会从体系中挥发了。随着加热的进行,硫酸氢乙酯分子振动幅度变大,温度达到170 ℃时,它自身发生分子内消去反应(高温加热脱小分子):
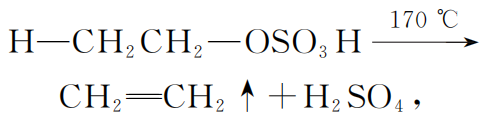
把催化剂浓硫酸再次释放出来.
显然,对于均相催化反应来说,所加催化剂的量不可过少,催化剂浓度不够则直接影响催化效果,并非想象中的“催化剂只用一点点就够了”。
b、表面催化
让我们以合成氨反应为例进行初步说明。
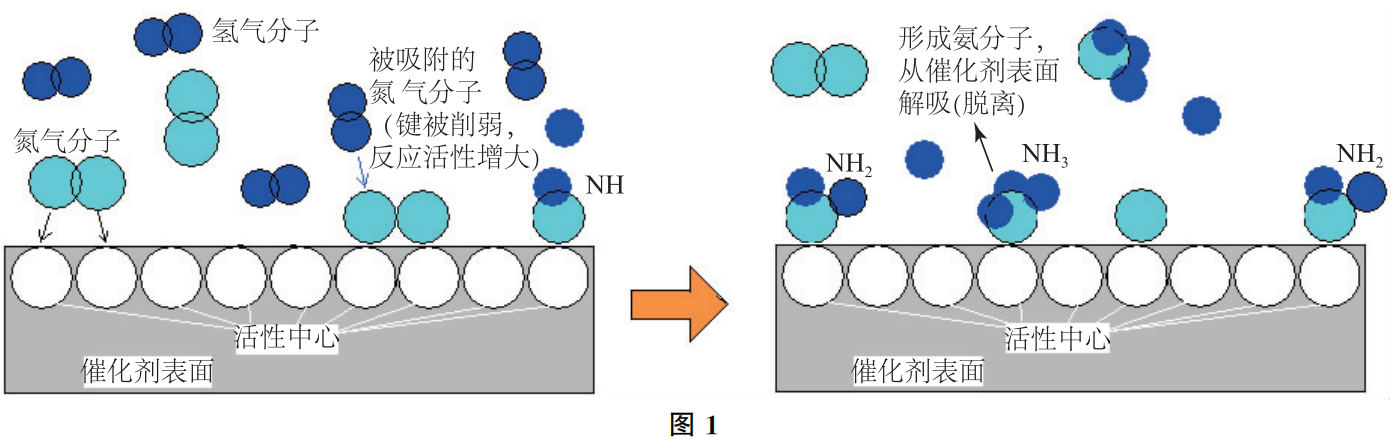
由于N2、H2分子结构很稳定,尤其是N2中三键结合极为牢固,合成氨反应的活化能很高,无催化剂时N2和H2几乎不会发生反应。研究发现,采用催化剂“铁触媒”后,由于N2可在催化剂表面发生化学吸附,使氮原子间的化学键削弱,接着化学吸附的氢原子一步步地与表面上的氮分子作用,在催化剂表面上逐步生成“—NH”、“—NH2”和“NH3”,最后氨分子在表面上解吸(解除吸附)而生成气态的氨,可简单地表示为:
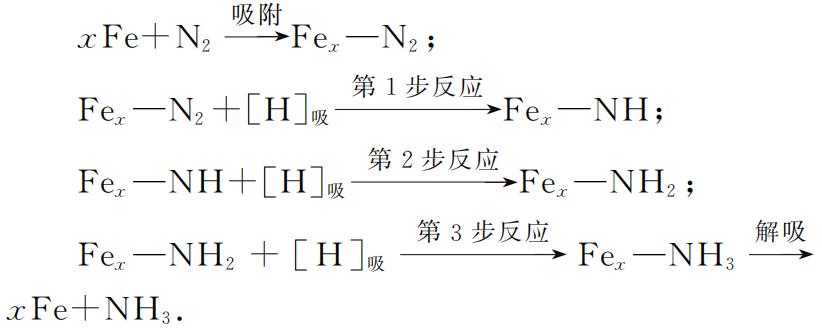
反应过程如图1所示.
其实也是表面催化机理(气体反应物SO2、O2分别在固态催化剂V2O5表面发生反应),虽然从历程上看,它更类似于前面的均相催化:
第1步:2SO2+2V2O5=2SO3+2V2O4;
第2步:2V2O4+O2=2V2O5.
显然,表面催化反应要求催化剂具备足够大的比表面积(即单位质量的表面积),这就是为什么常常把固体催化剂做成疏松多孔结构,或者尽可能粉碎的原因。事实上,在接触法制硫酸的关键设备“接触室”内,除热交换器外,整个空间都装满了吸附有V2O5催化剂的硅藻土(疏松、多孔、化学性质稳定);合成氨反应的合成塔内,也装入了数以吨计的催化剂“铁触媒”。
2、何谓催化剂中毒?如何“解毒”?
催化剂中毒,主要是指表面催化的固相催化剂因外力作用逐渐减弱甚至丧失催化作用的现象。从其催化作用机理可知,如果催化剂的表面被缩减(比如烧熔凝结)、被占据(比如落上固体尘埃;吸附了与之牢固结合的其他分子),都会导致催化效果减弱。
如果因温度过高导致催化剂烧熔凝结,则催化剂活性是无法恢复的。如果因催化剂表面积存尘埃导致活性减弱,要恢复活性也是非常困难的。所以在生产过程中以上情况都要尽量避免。
因吸附其他无关气体导致催化剂中毒的,有时依据吸附物的性质及平衡移动原理,可采取增大反应物浓度、流量等策略将毒物冲洗掉。无论哪种情况,都对催化剂活性的保持有巨大威胁,所以通过反应物的预先净化防止催化剂中毒,是要重点考虑的问题。
3、何谓“自催化”反应?
在做KMnO4溶液与草酸溶液反应实验时我们发现,两溶液混合后振荡,溶液的紫红色迟迟不褪,持续不断振荡的过程中,不知不觉间紫红色会骤然消失殆尽,这是因为,该反应的产物之一Mn2+,本身就是该氧化还原反应的催化剂。这种产物本身对反应具有催化作用,称为自催化现象。为验证Mn2+对该反应的催化作用,人教版教科书设置了向KMnO4、H2C2O4混合溶液中加少量MnSO4溶液的实验。
在大学分析化学的KMnO4溶液滴定H2C2O4溶液实验中,采取先滴加1mL KMnO4溶液,振荡,待其完全褪色后再逐滴滴定的方法,正是利用了先期反应产生的Mn2+对后续反应的催化作用。
中学化学里,还有一些反应属于自催化反应,如铜与浓硝酸的反应刚开始不够快,反应一旦开始,释放NO2气体的速率就会突然加快,有时快到难以预料的程度。这是因为NO2本身就是该反应的催化剂,再如,酯类物质水解产生的酸,也是酯进一步水解的催化剂。
所以大家在今后的实验过程中遇到类似现象时,要想一想反应是否属于这类自催化反应。

- 全部评论(0)
