关于氧化还原反应一些“细节”问题的讨论
时间:2020-04-14 11:02 来源:化学原理补正 作者:化学自习室 点击: 次 所属专题: 电极电势
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
氧化还原反应是一类常见且重要的化学反应。其本质是氧化剂与还原剂间发生了电子转移。其在溶液中的反应本质通常被表述为:

从电化学角度还可以进一步地将其描述为,两相关电对的电极电势值应该满足Φ(+)>Φ(-)。因为在这种情况下,其对应的电池电动势E才会大于零,该反应才会自发正向进行。
但是,一名化学教师仅知道这些理论及原则性的知识还是不够的。必须还要了解反应的实际情况,要清楚这个类型反应的一些细节。否则,在讨论某些氧化还原问题时,就难免会出现一些错误的说法,或得出一些错误的结论。
一、氧化还原反应的源动力
氧化还原反应进行的源动力,可以从多个不同的“理论”层次来解释。虽然有繁简之分,但没有优劣之别。因为它们对应的是,知识与理论基础均有所不同的学生。
1.定性的解释
在中学化学教学阶段,由于没有介绍电极电势的概念,只能依据物质是否有氧化性或还原性,及其相对的强弱来进行讨论。
而某些物质氧化性及还原性的强弱,学生只有通过实验、记忆及教师的“灌输”才会知道。
如,判断某金属单质与某金属离子间置换反应能否进行,就要通过已知的“金属活动性顺序表”来解决。
看到Hg在金属活动性顺序表中,比Ag更靠前。学生据此就可以判断出,Hg能够与Ag+离子自动发生,形式如“2Hg+2Ag+=Hg22++2Ag”的置换反应(要注意的是,这个反应不会得到Hg2+离子,因为它的氧化性比Ag+离子还要强)。
又如,通过亲自实验学生了解到Fe2+离子有一定的还原性,知道它能被O2所氧化。这样,教师只要再指出,氧化性比O2更强的物质还有许多,像H2O2、MnO4-离子、Cl2、Cr2O72-离子等。学生自然就可以写出,它们氧化Fe2+离子的反应方程式。
在高考对氧化还原反应要求越来越高的今天,学生了解一个由以非金属元素物种为主的氧化性强弱顺序,看来也是很有必要的。
上面给出的氧化性由强到弱的序列,当然还是源自于如下这些电对的标准电极电势值:Φo(H2O2/H2O)=1.776V,Φo(MnO4-/Mn2+)=1.491V,Φo(Cl2/Cl-)=1.358V,Φo(Cr2O72-/Cr3+)=1.23V,Φo(O2/H2O)=1.229V……。教师应该能根据教学的实际需要,自行对这个序列进行删补。
2.半定量的讨论
通过无机化学教学,学生掌握电极电势概念及能斯特方程后,就可以定量地讨论氧化还原反应进行的方向与限度了。
但是根据所讨论问题的模糊程度,方法还是有所区别的。
在讨论某一类反应时,由于只有一个氧化剂和还原剂的大致浓度范围,无法进行精确的计算。这时,就只能采取“半定量”方法来进行讨论。
这里仍以Hg能否与Ag+离子反应为例,看看这个讨论的具体方法:
查出相关的两个标准电极电势值,Φo(Ag+/Ag)=0.7996V,及Φo(Hg22+/Hg)= 0.7973V。
对于反应“2Hg+2Ag+=Hg22++2Ag”来说,Φo(Ag+/Ag)是原电池正极的电极电势。
这样,与反应对应的电池标准电动势就为,
Eo=Φo(+)-Φo(-)=Φo(Ag+/Ag)-Φo(Hg22+/Hg)= 0.7996-0.7973= 0.0023V。
因为这个Eo大于零。所以能够断定,上面所示的氧化还原反应可以自发地正向进行。
要看到的是,这里确实是偷换了一个概念。因为,反应自发进行的判别标准应该是E,而不是Eo。
但是,这也是情有可原的。
一是,在这种情况下无法计算出E,因为连[Ag+]的具体值都不知道。
二是,这里计算出的Eo与这个反应的平衡常数K密切相关。而平衡常数与反应的限度有直接联系。
所以,这个判断方法不但不是空穴来风,且有一定的理论基础。
况且,作为后续手段,人们还进而推导出“当n=1,Eo= 0. 3V(时),反应才能“完全”。这样一个判别该氧化还原反应,“是否可逆”的定量标准。
对于n=2的氧化还原反应的“可逆性”界限,教材中虽然没有给出来。但是仿此也不难计算出,对应的是Eo= 0.15V。大于这个值,这类反应才可以进行“完全”。
这样看,反应“2Hg+2Ag+=Hg22++2Ag”(其Eo= 0.0023V),进行的肯定不会达到“完全”这样的程度。也就是,在这个置换反应中Ag+离子的转化率有限。
至于Ag+离子的转化率到底是多少?就这种讨论问题的方法来说,那就无能为力了。
3.精确的电化学计算
在这么多年的无机化学教学中,笔者还真的没有就这类反应进行过,判断“反应能否进行”的计算。因为,即便给出了AgNO3溶液的初始浓度为1.0 mol•L-1,也从没有想到过要计算这样的问题。
其原因,一是没有必要,二是计算不会太容易。
既然这里讨论到了这个问题,那就硬着头皮来给大家示范一下吧。
计算的第一步,当然是对上述反应,写出能斯特方程,
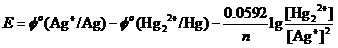
将已知数值代入该方程时才会注意到,[Hg22+]的起始浓度应该为0 mol•L-1。
这样,该反应的电池电动势就应该写为,
 。
。
似乎答案唾手可得。但是计算中遇到了一个“0的对数是多少”,这样的数学问题。而数学教师会告诉我们,0是没有对数的。
那么应该如何来进行这个计算呢?
其实,从数学的角度看,不妨把反应初始的[Hg22+]当做是一个无穷小的数值(比想象中的10-100还小得多),那样上方程中的lg([Hg22+]/[Ag+]2)项就是一个无穷大的负数。也就是电池电动势E为无穷大。此时,反应一定会正向进行。
这个所谓的“计算”只能是在讨论中完成,且结果E为无穷大。
早知道会这样,还计算它干什么?因为,从化学平衡的角度也可以得出,该反应一定会正向进行,这个同上的结论。
因为,在该反应平衡常数关系式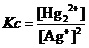 的分子上,[Hg22+]的数值竟然为零。这就意味着该反应的浓度商(Qc)一定是零,它肯定会小于任何可能的平衡常数c(不管它多小)。而浓度商要想达到平衡常数所要求的数值,反应就一定要向正反应的方向进行。
的分子上,[Hg22+]的数值竟然为零。这就意味着该反应的浓度商(Qc)一定是零,它肯定会小于任何可能的平衡常数c(不管它多小)。而浓度商要想达到平衡常数所要求的数值,反应就一定要向正反应的方向进行。
不难想象出,对于任意一个可逆反应,在没有平衡常数关系式中某产物项物质(它肯定是在分式的分子上)存在的情况下,它都一定是会正向进行的。
正因为如此,人们对于上面所示的能斯特方程,通常都不会去计算“反应能否进行”,而是只用它去计算某反应物的平衡转化率。
用能斯特方程计算这个反应中Ag+离子平衡转化率的方法为:
设平衡时[Hg22+]为x,则[Ag+]=1.0-2x。再令上式的左端为“0”(这是氧化还原反应达到平衡的标志),上面的能斯特方程就变为,
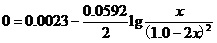 。
。
由此,就可以解出,x=0.26(mol•L-1)。即,该反应中Ag+离子的平衡转化率为2x/1.0=53%。
这个转化率的大小虽然还算是可以被接受。但这也似乎是在告诉我们,这个置换反应不但不彻底,甚至还会允许在某种情况下它显著地逆方向进行,也就是金属Ag可以倒过来去置换Hg。
下面就仍旧用这个式子(它对应的是平衡体系,所以从那边来讨论都可以)来继续计算一下。看看把金属Ag放到[Hg22+]=1.0 mol•L-1溶液中,反应达平衡时会有什么结果。
设平衡时[Ag+]=y。这样[Hg22+]为1.0-0.5y,则其上述能斯特方程就为,
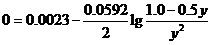
由此,可以解出,y=0.73(mol•L-1)。即,该反应中Hg22+离子的平衡转化率为0.73×0.5/1.0=0.37=37%。
这意味着,不活泼的单质Ag在Hg22+离子溶液中,竟然也能置换出单质Hg,而自身成Ag+离子进入到溶液中。并且是,直至有37%的Hg22+离子被反应掉,反应才会停止。
其实,反应“2Hg+2Ag+=Hg22++2Ag”,就是一个平衡常数K=1.2的反应。用能斯特方程, ,就可以计算出这个K的数值。
,就可以计算出这个K的数值。
这个平衡常数也表明,它是一个典型的可逆反应。
其原因在于,Hg的还原性只比Ag稍稍强了一点点。
二、氧化还原反应的结果
通常人们对于化学反应的结果,多限于从反应的产物是什么?转化率是多少?这样的两个方面来认识。
其实,仅仅这样还是不够的。应该看到,反应过程中反应物及产物性质的变化,也就是体系对反应产物性质的影响。
为讨论这个问题,应该把上面的能斯特方程,改写为如下,
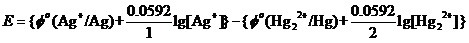
进而写为E=Φ(Ag+/ Ag)-Φ(Hg22+/ Hg),这样的形式。
由于,在反应正向进行的过程中,始终有E>0。也就是始终有Φ(Ag+/ Ag)>Φ(Hg22+/ Hg)。这就意味着,Ag+离子的氧化性始终要强于Hg22+离子的氧化性。
这也就是人们熟知的氧化还原反应通式:

并且,随着反应的进行,Φ(Ag+/ Ag)会逐渐地变小(因为体系中[Ag+]会逐渐降低),而Φ(Hg22+/ Hg)要慢慢地增大(因为[Hg22+]会逐渐增大)。
当氧化还原反应达到平衡状态时,会怎样呢?
由于此时的E=0。也就是达到了Φ(Ag+/ Ag)=Φ(Hg22+/ Hg),这样的状态。
这也就意味着,平衡时的Ag+离子氧化性与Hg22+离子的氧化性相等;同时Ag与Hg的还原性也相等。
这个讨论告诉我们三个重要的观点。
1,某物种的氧化性或还原性,一般还要受另一物种的影响。
其实,看到有如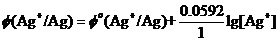 ,这样的关于电极的能斯特方程,就应该知道:Ag+离子氧化性与单质Ag的还原性(就是上式最左端的Φ(Ag+/ Ag)值大小),它是由两部分构成的。或者说,要受两方面的影响。
,这样的关于电极的能斯特方程,就应该知道:Ag+离子氧化性与单质Ag的还原性(就是上式最左端的Φ(Ag+/ Ag)值大小),它是由两部分构成的。或者说,要受两方面的影响。
一部分是元素的本性。它就是上式中间的Φo(Ag+/ Ag)项。这一项也确实常常对Φ(Ag+/ Ag)起着决定性的作用。它是矛盾的主要方面。
另一部分则是Ag+离子的浓度。它就是上式最右端的(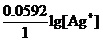 )项。在一般情况下它起着辅助性的作用。
)项。在一般情况下它起着辅助性的作用。
2,在氧化还原反应中各物质的氧化性或还原性,均不是一成不变。它们都要随着反应中某种离子浓度的变化,而发生改变。
原来大的Φ(如本例中的Φ(Ag+/ Ag)),会逐渐减小。在这个过程中,氧化态物种的氧化性要降低,还原态物种的还原性要增强。
而原来小的Φ(如本例中的Φ(Hg22+/ Hg)),会逐渐增大。也就是随着反应的进行,Hg22+离子的氧化性要增强,而Hg的怀远性要减弱。
3,对于氧化还原反应来说,其平衡状态就是一个,两电对的Φ值相等的状态。此时,体系中各物种的氧化能力均达到相等,各物种还原能力也已经趋同。
作为一名化学工作者必须知道,Ag+离子的氧化性要受其浓度影响,在反应进行中其氧化性要逐渐降低,在上述体系达平衡时Ag+离子与Hg22+离子的氧化能力是完全相同的。
如果不清楚这些观点,对氧化还原反应的理解,就只能算作是“一知半解”。
三、化学教学中的一些错误说法
对于任意一个达平衡状态的氧化还原反应,其中所有氧化态物种的氧化性必定相同,同时各还原态物种的还原性也均相等。这是一个相当重要的化学概念。
而有些化学教材,恰恰就无视或“忽视”了这个观点。在化学教学中也就出现了不止一个的,可以称之为“系统性”的错误。
比如,“把Cl2通入水中,会产生氧化性更强的HClO”。就是这个错误的代表。
这个说法无视“强氧化型1+强还原型2=弱氧化型2+弱还原型1”,这个氧化还原反应的普遍规律。试图硬行把数据Φo(Cl2/ Cl-)= 1.36V、Φo(HClO/ Cl2)= 1.63V,作为讨论问题的“依据”。
这也反映出,它们“忘记”了“标准电极电势”的含义。这种标准电极电势值,都是在各物种浓度(不包括Cl2)只能为1.0 mol•L-1,这种特定情况下得到的。并不能用来描述这个实验。
当然,他们也不清楚,氧化还原反应达到平衡状态的整个过程,实际就是一个各物种氧化能力及还原能力趋同的过程。在这个平衡体系中Cl2的氧化性与HClO应该是相同的。
在无机化学教学中,当然也有这样的问题存在。
如,在解释“王水可以溶解金和铂”这个现象时,教材就强调了王水中还含有“Cl2、NOCl等强氧化剂”。
其根据就是,体系中有平衡,HNO3+3HCl=Cl2+NOCl+2H2O。而从标准电极电势看,“Cl2、NOCl”的氧化性比HNO3要强。
问题是,即便体系中有Cl2、NOCl,这些氧化还原反应的产物。在这个平衡体系中它们能比仍共存的反应物HNO3的氧化性更强吗?
不难想象出来,如果Cl2、NOCl的氧化性真比HNO3强,上述反应一定是要逆向进行的。
对于每一类化学反应的驱动力,变化过程,反应的结果,都要有这样清楚的认识。这才是一个严谨的教学态度。
参考文献
[1]北京师范大学等校.无机化学(第三版).高等教育出版社. 1992年

- 全部评论(0)
