为什么酸性增强,氧化性增强?
时间:2021-03-02 09:57 来源:未知 作者:化学自习室 点击: 次 所属专题: 氧化性
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
先举几个例子,NO3-在有H+的时候才有氧化性,KMnO4一般都要酸化,重铬酸跟也需要酸化,ClO-也需要酸化增强其漂白性……
其实不仅是上面的几个酸根需要酸化提高氧化性,很多其他物质的氧化性也跟pH有很大关系,比如O2。
这里从两个方面分析为什么酸性能影响氧化性!
一、从结构分析
按惯例,先扯几个概念,第一个是电子云,这个好懂,请同学们自行阅读相关资料
第二个是离子极化作用
说白了就是异性电荷的相互吸引作用
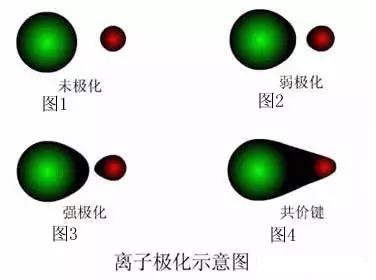
看图1,正常的阴阳离子,未受到异性电荷的作用力,电子云为球形、均匀分布的,这个属于未极化离子,纯属理想情况,化合物中一般不存在
看图2,阴阳离子,受到了异性电荷微弱的吸引力,电子云稍微变形,这个属于弱极化离子,比如CsF就是这样
看图3,阴阳离子,受到了异性电荷较强的吸引力,电子云变形较大,这个属于强极化离子,比如MgCl2就是这样
看图4,阴阳离子,受到了异性电荷强烈的吸引力,电子云变形严重,已经部分重叠,离子键变成了共价键,比如AlCl3就是这样
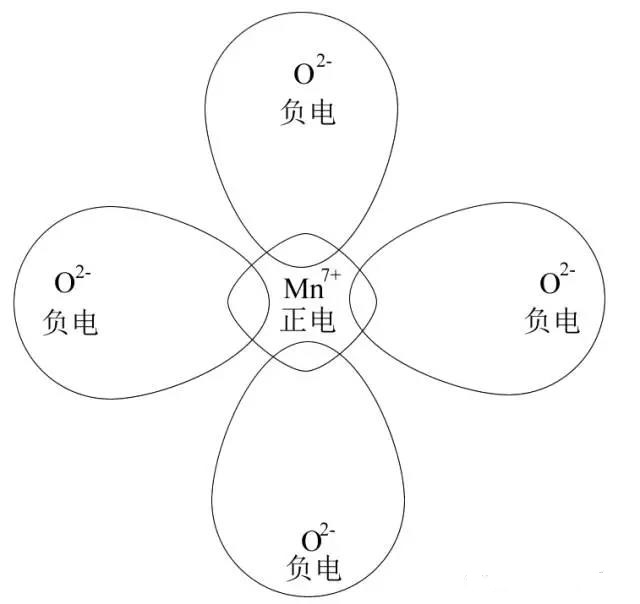
然后进入正题!以MnO4-为例,下图是MnO4-离子极化作用示意图
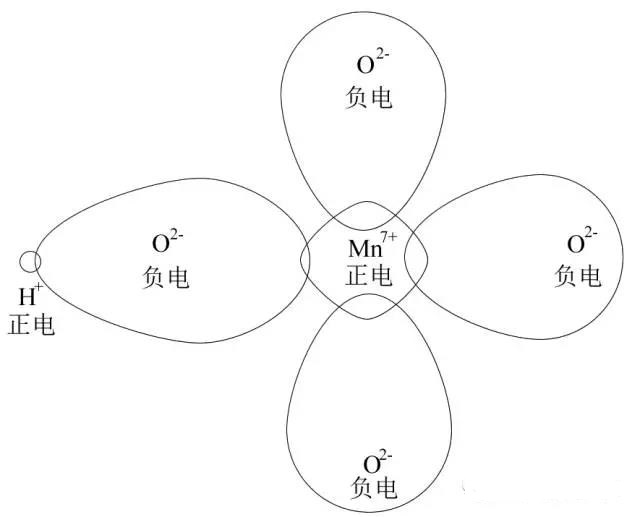
当有H+靠近时,由于H+半径太小,产生很强烈的吸引力(解释:虽然在这里离子不是点电荷,但也可以参考库伦力公式![]() ,),导致O的电子云强烈向H+这边变形,是Mn与O的电子云重叠程度降 低,Mn-O键变得不那么稳定,因此氧化性増强,这个叫反极化作用,如下图
,),导致O的电子云强烈向H+这边变形,是Mn与O的电子云重叠程度降 低,Mn-O键变得不那么稳定,因此氧化性増强,这个叫反极化作用,如下图
为什么不稳定就会使氧化性增强?
这里打个比方,因为容易断嘛,断了后Mn(VII)就要吸引别的微粒,像氧比较耐吸就结合在一起,如果遇到不耐吸的,比如S2-,一吸就投降,S2-直接把电子给了Mn(VII),那就是氧化还原反应了。
中心原子价态越高,抵抗反极化作用的能力就越强,这也是为什么稳定性ClO-<ClO2-<ClO3-
除了H+反极化作用很强外,其他电荷高、半径小的离子反极化作用也很强,也可以使酸根离子不稳定,比如碳酸钙的热稳定性就低于比碳酸钠的。
二、从物化角度分析
按惯例先来个概念,电极电势
电极电势是用来衡量水溶液中,微粒的氧化还原性强弱的,数值越正代表氧化性越强,数值越负代表还原性越强。
相应的有个公式计算电极电势,叫做能斯特方程
举个例子

大部分物质的氧化性都随H+浓度增大而增强。

- 全部评论(0)
