从有机物的结构简式推导计算分子式
时间:2020-04-25 19:25 来源:化学小站微信公众号 作者:海之子313 点击: 次 所属专题: 有机物分子式计算
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
有机化学是高考化学的重头戏,选择题2道+实验大题1道(可能)+有机化学选做题,这样算下来,总分100分的化学,有机分值超过了40分。所以,忽略了有机化学的人,必然会付出沉重的代价。
今天讲的内容主要是有机化学选择题的一个选项,这个选项就是给出一个复杂有机物的结构简式,然后问该有机物的分子式是什么?即C多少,H多少,O多少,N多少等。当然,这种题型也有可能出现在有机化学的选做题里。
1、不饱和度与C、H、O分子式的关系
在讲有机物的分子式之前,我们先讲一个已经被课本教材淘汰了的概念:不饱和度。
不饱和度,又称缺氢指数或者环与双键指数,是有机物分子不饱和程度的量化标志,用希腊字母Ω表示。为什么淘汰了东西还要讲呢?因为不饱和度对推算有机物的分子式有非常有用,这个我们往后再说。
烷烃的通式是CnH2n+2。注意,这个通式只能是烷烃的通式,不可能是其它任何烃类的通式了。因为2n+2个氢原子,是n个碳原子全部以单键相连接),所能连接的最大数目。如果有人说,某烃类的通式为CnH2n+3,那他一定是胡说八道。
烯烃的通式是CnH2n,和烷烃相比,多了一个碳碳双键,少了两个氢原子。所以我们暂时得出结论,每多一根双键(不止是碳碳双键),就会少两个氢原子,此时的Ω=1。
环烷烃的通式也是CnH2n,和烷烃相比,多了一个碳环,少了两个氢原子,所以我们继续得出结论,每多一个环(不止是碳环),就少两个氢原子,此时的Ω=1。
综合以上两点可得出结论:有机物中每多一个双键或一个环,不饱和度Ω数值就增大1,氢原子同时就少两个。这点很重要。在考试中,经常有题目给一个复杂有机物的结构简式,然后问你它的分子式是什么。这个时候,碳原子容易数清楚,氧原子也容易数清楚,但是氢原子很容易数错。为了避免出错,我们就可以用不饱和度的减法,去推测有机物的分子式了,效率很高的。
炔烃的通式是CnH2n-2,和烷烃相比,多了一个碳碳三键,少了四个氢原子。所以我们得出结论,每多一个碳碳三键,就少四个氢原子,此时的Ω=2。当然,发散思维来看,CnH2n-2也可以是二烯烃的通式,也可以是环烯烃的通式,甚至可以是二环烃的通式,只要满足Ω=2即可。
芳香烃的通式是CnH2n-6,和烷烃相比,多了三个碳碳双键(实际上并不是)和一个环,少了八个氢原子。所以我们得出结论,每多一个苯环,就少八个氢原子,此时的Ω=4。
醇类的通式是CnH2n+2O,充分说明在醇分子中,所有的共价键都是单键相连的饱和状态。同时,CnH2n+2O也是醚类的通式。如乙醇和二甲醚是同分异构体,丙醇和甲乙醚是同分异构体。
醛类的通式是CnH2nO,充分说明在醛分子中,有一个不饱和度,事实上在醛类中确实存在一个羰基(碳氧双键)。同时,CnH2nO也是酮类的通式。如丙醛和丙酮是同分异构体。
羧酸类的通式是CnH2nO2,充分说明在羧酸分子中,虽然有两个氧原子,但也只有一个不饱和度,事实上在羧酸里也有一个羰基(碳氧双键)。同时,CnH2nO2也是酯类的通式。如乙酸和甲酸甲酯是同分异构体。
2、含有氮原子和卤原子有机物分子式的推导
如果是纯N、H组成的化合物,它们都以单键相接,一个N的起始物质是NH3,2个N就成了N2H4,3个N就是N3H5……通过观察不难发现,每加1个N,同时就多加1个H,最后形成物质的通式是NnHn+2。
如果多一个双键或者一个环,与C、H化合物同理,便卸下2个H,同时多了一个不饱和度。如下面这个化合物,这是一个纯N、H组成的化合物,它的分子式如果都饱和了,应为N8H10,但现在有两个双键、一个环,所以有3个不饱和度,故而最终的分子式为N8H4。
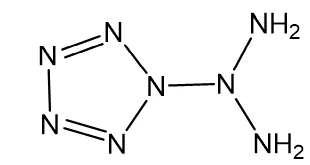
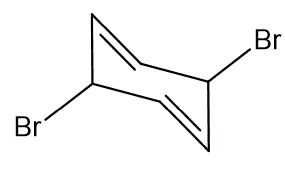
如果有机物里有卤原子(-X)基团,要减去相应数目的氢原子(-H原子),如下面的这个有机物,理论上应该是C6H14,后来呢,加了1个环环,多了两个双键键,不饱和度有3个,那分子式是C6H8,可是这里还有两个-Br取代了-H的位置,所以最终的分子式是C6H6Br2。
我们最后来一个难点的有机物(ph代表苯环),请推导出它的分子式。
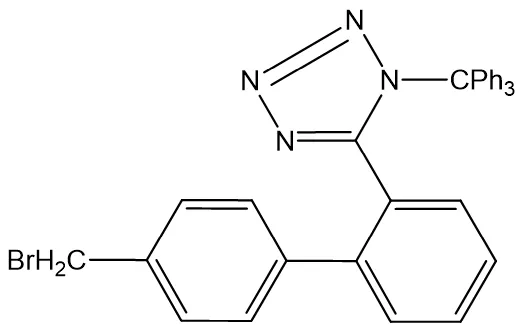
【解答】碳原子的数目没啥好办法,老老实实数吧,5个苯环共计30个C,再加上侧链上还有3个C,共计有33个C。N原子数,你只要不瞎,就能看清楚有4个,加了4个N,自然需要加4个H。在饱和状态下,氢原子的理论数目应该是68+4=72个(即C的68个H+N的4个H)。
现在开始算不饱和度:
第一,1个苯环4个Ω,5个苯环就是20个Ω,需要减去40个H;
第二,该有机物中还一个杂环,杂环里有两个双键,这里还要减掉3个不饱和度,即6个H;
第三,该有机物里还有一个-Br,再去掉1个H。
最后去掉共计40+6+1个H,即剩下72-47=25个H,最后的分子式是C33H25N4Br。
继续加强巩固练习,下列两个有机物的分子式是什么?
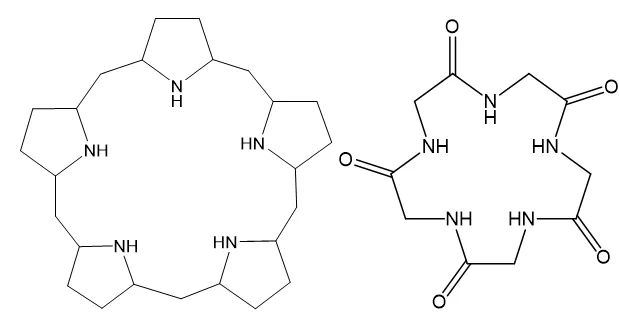
第一个有机物,老规矩,数碳原子数目有25个,在饱和键情况下接52个H,但是有5个小环和1个大环,共计6个不饱和度,所以剩下40个H,此外,还有5个N,同时加5个H,最后一共是45个H,即C25H45N4。
第二个有机物,老规矩,数碳原子数目有10个,在饱和键情况下接22个H,但是有1个大环和5个碳氧双键,共计6个不饱和度,所以剩下10个H,此外,还有5个N,同时加5个H,最后一共是15个H,即C10H15N5O5。
3、“立体”有机物分子式的推导
我必须提前声明一点,其实这里的“立体有机物”是相对于前面的“平面有机物”来说的。但是前面的“平面有机物”也并非真正的平面,比如说环己烷的6个碳原子,它们也不在同一个平面里,理论上也是空间立体结构。不过,希望你可以理解我的意思。如果不理解,没关系,看看下面的例子你就懂了。
我们给出3个物质的“立体分子”结构。从左到右分别是立方烷、金刚烷、三棱柱烷。
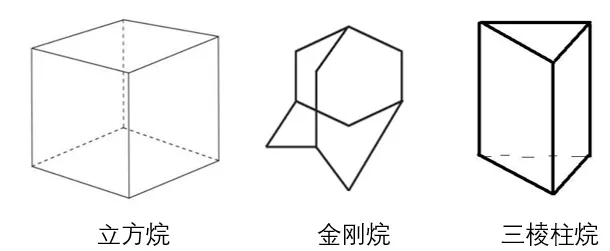
立方烷的分子式是C8H8,比起饱和烃差了10个H,有5个不饱和度。
金刚烷的分子式是C10H16,比起饱和烃差了6个H,有3个不饱和度。
三棱柱烷的分子式是C6H6,比起饱和烃差了8个H,有4个不饱和度。
深入分析,立方烷有6个面,最后有5个不饱和度。
同理可得,金刚烷有4个面,最后有3个不饱和度。
同理可得,三棱柱烷有5个面,最后有4个不饱和度。
所以,你大概能得出什么结论来了吧?
在我们所谓的“立体分子”结构中,不饱和度加1就等于面数。
列出公式:Ω+1=F(Ω是不饱和度,F是面数)。
当然,你可能会困惑,在“平面结构”中,每多1个环,就多1个不饱和度,为什么在“立体分子”结构中这个规律会被打破呢?其实解释起来也非常简单:最后一个面是被动形成的。以立方烷为例说明,虽然这是个正六面体,但是当5个面合拢后,第6个面就自然形成了,这个自然形成的面,自然就不作数,要知道,这家伙还有另一个名字叫五环辛烷(啊,五环,你比六环少一环)。
继续加强巩固练习,下列两个有机物的分子式什么?
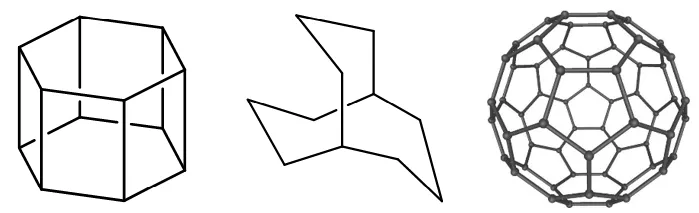
第一个有机物(如果有的话),12个碳,饱和情况下接26个H,但是现在有8个面,即7个不饱和度,所以,最后的分子式是C12H12。
第二个有机物,11个碳,饱和情况下接24个H,但是现在有3个面,即2个不饱和度,所以,最后的分子式C11H20。
第三个有机物(其实这不是有机物了),60个碳,饱和情况下接122个H,但是现有32个面(12个正五边形+20正六边形),即31个不饱和度。同时,我再告诉你另一个已知条件:这个物质里有90个碳碳键,其中30个碳碳双键,即还有30个不饱和度。最后一共有61个不饱和度,共计减去122个H,即纯C60。

- 全部评论(0)
