常见热力学符号的意义
时间:2020-09-22 15:04 来源:未知 作者:化学自习室 点击: 次 所属专题: 热力学
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
热力学是研究能量相互转变过程中所遵循的法则的一门学科,属于物理学的分支,化学热力学专门研究和化学反应相关的能量问题,也是研究化学反应的方向和进行程度的一门科学。
处于平衡态的热力学体系,各宏观物理量具有确定的值,而且这些物理量值由体系所处的状态所决定,与达到平衡态的过程无关,被称之为状态函数,其运算规则符合盖斯定律。
一、热力学状态函数的标准
化学热力学体系的某些热力学函数(如内能、焓、熵、吉布斯自由能等)在某一任意指定状态下的绝对值是无法测定的,而只能求出由于体系的温度、压力或组成等条件的改变而引起上述热力学函数的变化值。因此,为了便于表达和计算这些热力学函数及其变化,基于盖斯定律,热力学中人为地为状态函数定义设立一个共同的基线,就是标准热力学函数(标准生成焓、标准熵、标准吉布斯自由能)。
标准热力学函数的“标准”有两种含义:
1. 基于外界条件的“标准”
中国国家标准GB3102.8—93《物理化学和分子物理学的量和单位》中,对物质在不同聚集状态的标准态分别做出规定,就无机化学而言,标准态可以理解为:
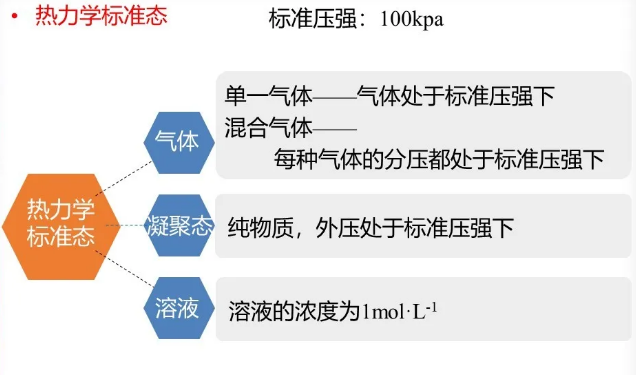
在标准态下的热力学函数值称为标准函数,例如标准熵。
值得注意的是,标准态没有规定温度,所以标准函数值将随温度而变化,即标准热力学函数的值只是体系的温度的函数,而与体系的压力及组成无关。根据国际纯粹与应用化学联合会的推荐,可选取273.15K、298.15K和303.15开作为参考温度,优先推荐298.15开作为参考温度。通常表中查到的数值是标准态298.15K下的热力学函数值。
2. 基于自身相对值的“标准”
热力学状态函数的绝对值是无法测定的,因此为每个函数人为规定一个标准,基于盖斯定律测定和求算对于此标准的相对变化值,作为研究化学反应相关能量和进行程度的参数。如标准摩尔生成焓,标准摩尔吉布斯自由能等。
二、常见的热力学状态函数
常见的热力学状态函数有焓、熵和吉布斯自由能,根据其不同的条件其表示方式不同。
1. 焓

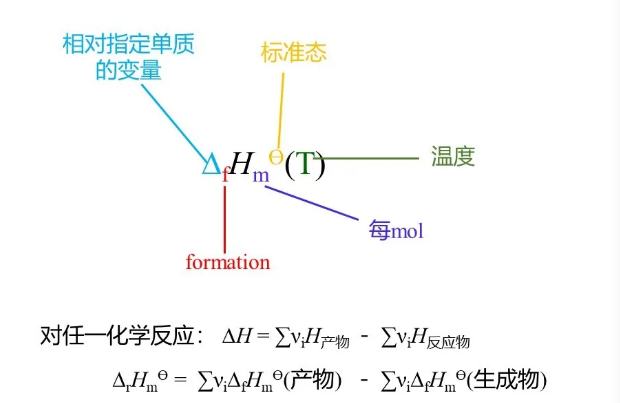



相类似的,其他一些热效应也有其专有名称。例如燃烧热。

水溶液中的离子总是成对出现的,因此也只能设立一个标准才可以测定和计算出其他离子的生成焓。就以最简单的水合氢离子为标准吧!

2. 吉布斯自由能

吉布斯自由能的标准设置和焓完全一致,以指定单质和水合氢离子的标准摩尔生成吉布斯自由能为0。
3. 熵

与焓和吉布斯自由能不同的是,熵是有绝对值的。所以物质的熵就不是标准摩尔生成熵了,而就是标准摩尔熵。

三、热力学状态函数符号辨析
热力学状态函数用一个大写符号表示,其所处状态和意义也是用符号表示的。怎样来区分这么多的符号?
先来辨析一下:

再来看看他们之间的关联:



- 全部评论(0)
