化学反应的焓変与键能关系辨析
时间:2022-07-23 17:13 来源:未知 作者:李景海 点击: 次 所属专题: 键能 焓変
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
化学反应的焓变是新课标要求掌握的一个基本概念,它与键能的关系密切。这是因为反应的实质是组成反应物的各种化学键的破坏与组成生成物的各 种化学键的形成。在此过程中,必然伴随着能量的变 化,其表现形式为热量的放出或吸收。这种热量的变化,反映了与键能密切相关的反应物与生成物的总能量间的差额。因此,在中学化学教学中总结出反应焓变与键能的经验公式:
ΔH =∑E反应物-∑E生成物
其中表示反应焓变,∑E反应物和∑E生成物分别 表示反应物与生成物的键能总和。
例如:对于反应 H2(g) +Cl2(g) =2HCl(g)
已知:EH-H= 436 kJ/mol,ECl-Cl= 243 kJ/ mol,EH-Cl = 431.4 kJ/mol
根据经验公式:ΔH =∑E反应物-∑E生成物= 436 kJ/mol + 243 kJ/mol - 431.4 kJ/mol ×2=-183. 8 kJ/mol
根据化学反应的实质可将反应过程设计为:
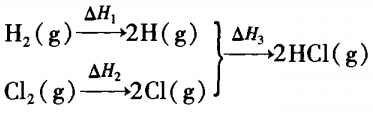
其中 H2(g)→2H(g)
ΔH1 =EH-H =436 kJ/mol
Cl2(g)→2Cl(g)
ΔH2 =ECl-Cl =243 kJ/mol
2H(g) +2Cl(g) →2HCl(g)
ΔH3 =2EH-Cl= -862. 8 kJ/mol
根据盖斯定律可知整个反应过程的焓变是各个过程焓变的总和,即:
2H2(g) +Cl2(g) =2HCl(g)
ΔH=ΔH1 +ΔH2 +ΔH3 ==436 kJ/mol +243 kJ/mol + ( -862.8kJ/mol)==-183.8 kJ/mol
显然,上述反应的焓变完全可以认为是反应物与生成物的键能总和之差。
但是,上述计算公式并不能适应所有化学反应。 如对于某些离子化合物的形成,或有非气态物质参与反应或生成,以及在溶液中进行的化学反应时,情况 就有所不同了。例如:
2Na(s) +Cl2(g) =2NaCl(s) ΔH =?
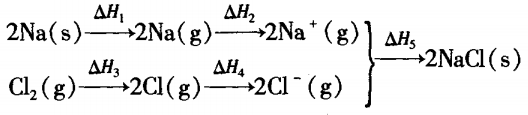
其中 ΔH1等于Na的升华能的二倍;ΔH2等于Na 的电离能的二倍;ΔH3=ECl-Cl;ΔH4数值上等于Cl的 电子亲合能;ΔH5数值上等于NaCl晶体的晶格能。
根据盖斯定律可得:
ΔH = ΔH1+ΔH2+ΔH3+ΔH4+ΔH5 =215.7 kJ/mol+985.6 kJ/mol +242.4 kJ/mol + ( -723.1 kJ/mol) + (-1543.2 kJ/mol) = -882.6 kJ/mol
计算所得的NaCl(s)的反应热和实验测定的结 果基本一致,但若用经验公式进行计算,则误差比较 大,其中原因一是由于分析时简化了反应过程,忽略 了 Na(g)→Na+(g)的电离能和 Cl(g)→ Cl-的 电子亲合能;二是混淆了一些相关概念,如Na(s) → Na(g)的升华能和Na(g)的键能不可等同视之, 二者数值不等;同样NaCl的键能和NaCl晶格能概念不同、数值也不相等。
可见根据键能计算反应焓变,仅仅是一个近似计算,它适应于简单气态分子生成较简单气态分子这样 一类反应。
运用ΔH =∑E反应物-∑E生成物计算反应焓变,有 助于学生从物质结构角度了解反应焓变的实质。在 反应过程中,若产物键能总和大于反应物的键能总和,则意味着成键放热大于断键吸热,反应是放热反应;反之,则为吸热反应。对于比较复杂的反应,产生较大误差的原因可能是:
1.键能是指气态条件下断开1 mol化学键变成气 态原子时所需的能量,而实际上参加反应的物质不 一定处于气态,且产物也不一定是由气态原子形成的气态分子,因此在计算形成NaCl(s)的反应焰变时, 必需考虑升华能、电离能、电子亲合能等因素。若是在溶液中的反应,除了溶质的电离能之外可能还需考虑溶剂化过程中的溶剂化能等。
2.键能是忽略了许多因素,用宏观方法测定出来的一个平均值。键能反映了不同分子中同类化学键的 共性,而忽略了它们的特殊性。如NH3分子中有三个 N-H键,断开第二个N-H键时,由于条件有所变化,所需能量和断开第一个N—H键必然有所不同,而实 际上N—H键的'键能是这三个N—H键的离解能的平均值。另外,由于分子中不同原子及原子团之间存在相互影响,即使是相同类型的化学键,所处环境不同, 键能也会有所不同,甚至差别较大。例如水、乙醇、苯酚及乙酸中的O-H键的键能差别就比较大,就是甲烷和乙烷中的C一H键的键能也略有差异。
因此,对于一个具体的化学反应而言,化学反应的焓变并不单纯取决于各种化学键的键能,键能只是决定反应焓变的主要因素,但绝不是唯一 的因素。应用该经验公式时,不仅要考虑各种化学键的键能代数和,而且还需要分析发生这一反应的各种具体条件。所以在实际应用过程中,科学家一般都是通过相关的实验直接利用量热计来测出各种物质的生成热或燃烧热,然后采用这些已知的生成热或燃烧热数据来计算各种反应的焓 变,对于那些反应速率很慢或伴有副反应发生甚 至不能直接进行的反应,则可以运用盖斯定律计算出它们的反应热。

- 全部评论(0)
